题目内容
2.下列关于有机物的叙述,正确的是( )| A. | 石油的分馏和煤的气化都是发生了化学变化 | |
| B. | 苯、溴水、铁粉混合可制成溴苯 | |
| C. | 糖类、油脂、蛋白质在一定条件下均可以水解 | |
| D. | 石油裂化的主要目的是提高轻质液体燃料的产量和质量 |
分析 A、煤的气化是用煤来生产水煤气的过程;
B、苯只能和液溴反应;
C、糖分为单糖、二糖和多糖;
D、石油裂化获得轻质油.
解答 解:A、煤的气化是用煤来生产水煤气的过程,有新物质生成,故为化学变化,而石油的分馏是利用各组分的沸点的不同,用加热的方法将各组分分离的方法,故为物理变化,故A错误;
B、苯只能和液溴反应,和溴水不反应,故B错误;
C、糖分为单糖、二糖和多糖,而单糖不能水解,故C错误;
D、石油裂化获得轻质油,即石油裂化的目的是提高轻质油的产量和质量,故D正确.
故选D.
点评 本题考查了煤和石油的综合利用,难度不大,应注意油脂和蛋白质均能水解,但糖类不一定能水解.

练习册系列答案
相关题目
9.某有机物A的结构简式如图所示,下列有关叙述中正确的是( )


| A. | 它有酸性,不能与NaHCO3溶液反应 | B. | 不能使溴水褪色 | ||
| C. | 1molA最多能和7mol NaOH反应 | D. | 1molA最多能和6mol H2反应 |
13.将纯水加热至较高温度,下列叙述正确的是( )
| A. | 水的离子积变大,c(H+)变大,呈酸性 | B. | 水的离子积不变,c(H+)不变,呈中性 | ||
| C. | 水的离子积变小,c(H+)变小,呈碱性 | D. | 水的离子积变大,c(H+)变大,呈中性 |
10.在四只烧杯中分别注入下列物质的稀溶液,用惰性电极电解一段时间后,烧杯中溶液pH减小的是( )
| A. | MgCl2 | B. | Na2SO4 | C. | Na2CO3 | D. | AgNO3 |
17.下列有关化学与自然的开发利用描述中不正确的是( )
| A. | 可用热分解法冶炼氧化汞得到水银 | |
| B. | 从自然界中提炼金属要经过矿石的富集、冶炼、精炼三步 | |
| C. | 铝热法炼铁的反应需要高温的条件,所以是吸热反应 | |
| D. | 金属单质被发现和应用得越早,其活动性一般越弱 |
7.某航空站安装了一台燃料电池,该电池可同时提供电和水蒸气,所用燃料为氢气,电解质为熔融的碳酸钾.已知电池的总反应为2H2+O2═2H2O,正极反应为O2+2CO2+4e-═2CO32-.下列说法正确的是( )
| A. | 该电池可在常温或高温时工作 | |
| B. | 负极反应为H2+2OH--2e-═2H2O | |
| C. | 该电池工作时负极有CO2生成 | |
| D. | 该电池供应1molH2O,同时转移1mol电子 |
14.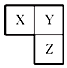 X、Y、Z三种短周期元素在周期表中的相对位置如图所示,Y原子的最外层 电子数是次外层电子数的3倍,下列说法正确的是( )
X、Y、Z三种短周期元素在周期表中的相对位置如图所示,Y原子的最外层 电子数是次外层电子数的3倍,下列说法正确的是( )
 X、Y、Z三种短周期元素在周期表中的相对位置如图所示,Y原子的最外层 电子数是次外层电子数的3倍,下列说法正确的是( )
X、Y、Z三种短周期元素在周期表中的相对位置如图所示,Y原子的最外层 电子数是次外层电子数的3倍,下列说法正确的是( )| A. | 在三种元素形成的简单气态氢化物中,Y的气态氢化物沸点最高 | |
| B. | Z元素的氧化物对应的水化物一定是一种强酸 | |
| C. | 三种元素原子半径的大小顺序为:X>Y>Z | |
| D. | Z的单质与Fe反应生成的化合物中,铁元素显+3价 |
11.下列事实可用同一原理解释的是( )
| A. | SO2和植物油都可以使溴水褪色 | |
| B. | 乙醛和葡萄糖溶液都能使KMnO4酸性溶液褪色 | |
| C. | 铜和纤维素在一定条件下都能与HNO3反应 | |
| D. | 烧碱和硬脂酸钠的溶液都显碱性 |
19.某同学做同周期元素性质递变规律实验时,自己设计了一套实验方案,并记录了有关实验现象如下表.
请你帮助该同学整理并完成实验报告:
(1)实验目的:探究同周期元素的金属性和非金属性的递变规律.
(2)实验用品:
仪器:①试管②酒精灯③胶头滴管④试管夹⑤镊子⑥小刀⑦玻璃片⑧砂纸⑨烧杯等.
药品:钠、镁带、铝条、2molL-1的盐酸、新制的氯水、饱和的H2S溶液等.
(3)实验内容:(填写与实验方案相对应的实验现象)
①B②E③A④D⑤C(用A-E表示)
写出③的离子方程式$2Na+2{H}_{2}O=2N{a}^{+}+2O{H}^{-}+{H}_{2}↑$.
(4)实验结论:金属性:Na>Mg>Al
非金属性:Cl>S.
| 实验方案 | 实验现象 |
| ①用砂纸擦后的镁带与沸水反应,再向反应后溶液中滴加酚酞 | (A)浮于水面,熔成一个小球,在水面上无定向移动,随之消失,溶液变红色 |
| ②向新制的H2S饱和溶液中滴加新制的氯水 | (B)产生气体,可在空气中燃烧,溶液变成浅红色 |
| ③钠与滴有酚酞试液的冷水反应 | (C)反应不十分强烈,产生的气体可以在空气中燃烧 |
| ④镁带与2molL-1的盐酸反应 | (D)剧烈反应,产生可燃性气体 |
| ⑤铝条与2molL-1的盐酸反应 | (E)生成淡黄色沉淀 |
(1)实验目的:探究同周期元素的金属性和非金属性的递变规律.
(2)实验用品:
仪器:①试管②酒精灯③胶头滴管④试管夹⑤镊子⑥小刀⑦玻璃片⑧砂纸⑨烧杯等.
药品:钠、镁带、铝条、2molL-1的盐酸、新制的氯水、饱和的H2S溶液等.
(3)实验内容:(填写与实验方案相对应的实验现象)
①B②E③A④D⑤C(用A-E表示)
写出③的离子方程式$2Na+2{H}_{2}O=2N{a}^{+}+2O{H}^{-}+{H}_{2}↑$.
(4)实验结论:金属性:Na>Mg>Al
非金属性:Cl>S.