题目内容
7.某航空站安装了一台燃料电池,该电池可同时提供电和水蒸气,所用燃料为氢气,电解质为熔融的碳酸钾.已知电池的总反应为2H2+O2═2H2O,正极反应为O2+2CO2+4e-═2CO32-.下列说法正确的是( )| A. | 该电池可在常温或高温时工作 | |
| B. | 负极反应为H2+2OH--2e-═2H2O | |
| C. | 该电池工作时负极有CO2生成 | |
| D. | 该电池供应1molH2O,同时转移1mol电子 |
分析 A.该电池使用的电解质是熔融的碳酸钾,在常温下无法工作;
B.总反应为2H2+O2═2H2O,则负极反应=总反应-正极反应式;
C.根据负极的反应式来确定;
D.由反应可知,生成2molH2O转移4mol电子.
解答 解:A.该电池使用的电解质是熔融的碳酸钾,在常温下无法工作,故A错误;
B.放电时,电池的总反应为2H2+O2═2H2O,正极反应为O2+2CO2+4e-═2CO32-,则负极反应为:2H2-4e-+2CO32-═2CO2+2H2O,故B错误;
C.负极反应为2H2-4e-+2CO32-═2CO2+2H2O,有C02生成,故C正确;
D.由反应可知,生成2molH2O转移4mol电子,则该电池供应1molH2O,同时转移2mol电子,故D错误;
故选:C.
点评 本题考查化学电源新型电池,明确负极反应=总反应-正极反应式是解答本题的关键,注意离子的移动方法及利用化合价分析转移电子,题目难度中等.

练习册系列答案
相关题目
18.决定核素种类的是( )
| A. | 质子数 | B. | 质子数和中子数 | C. | 中子数 | D. | 核外电子数 |
15.电子计算机所用钮扣电池的两极材料为锌和氧化银,电解质溶液为KOH溶液,其电极反应是:
Zn+2OH--2e-═ZnO+H2O;Ag2O+H2O+2e-═2Ag+2OH-.下列判断正确的是( )
Zn+2OH--2e-═ZnO+H2O;Ag2O+H2O+2e-═2Ag+2OH-.下列判断正确的是( )
| A. | 锌为正极,Ag2O为负极 | |
| B. | 锌为负极,Ag2O为正极 | |
| C. | 原电池工作时,将电能转化成化学能 | |
| D. | 原电池工作时,负极区溶液pH增大 |
2.下列关于有机物的叙述,正确的是( )
| A. | 石油的分馏和煤的气化都是发生了化学变化 | |
| B. | 苯、溴水、铁粉混合可制成溴苯 | |
| C. | 糖类、油脂、蛋白质在一定条件下均可以水解 | |
| D. | 石油裂化的主要目的是提高轻质液体燃料的产量和质量 |
12.某有机物的结构简式如图所示,下列关于该有机物的性质说法错误的是( )
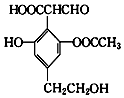

| A. | 该物质可以使酸性KMnO4溶液褪色,也可发生消去反应 | |
| B. | 该物质可与H2反应,1mol该物质最多消耗5mol H2 | |
| C. | 可以与FeCl3溶液反应显色,也可与Ag(NH3)2OH反应 | |
| D. | 可以与NaHCO3溶液反应放出CO2气体 |
16.以Zn和Cu为电极,稀H2SO4为电解质溶液形成的原电池,某实验兴趣小组做完实验后,在读书卡片上记录如下:
(1)卡片中记录合理的是③④⑥(填序号)
(2)该电池总反应的离子方程式是Zn+2H+=Zn2++H2↑
(3)若将稀硫酸换成硫酸铜溶液,电极质量增加的是铜极 (填“锌极”或“铜极”)
| ①Zn为正极,Cu为负极 ②H+向负极移动 ③Cu极有H2产生 ④电子流动方向Zn→Cu ⑤正极的电极反应式是Zn-2e-=Zn2+ ⑥若有1mol电子流过导线,则理论上产生0.5mol H2 |
(2)该电池总反应的离子方程式是Zn+2H+=Zn2++H2↑
(3)若将稀硫酸换成硫酸铜溶液,电极质量增加的是铜极 (填“锌极”或“铜极”)
 有A、B、C、D、E、F六种微粒,E气体能使湿润的红色石蕊试纸变蓝色其中A~E五种微粒均由两种元素组成且均含10个电子,它们有如图所示的转化关系:
有A、B、C、D、E、F六种微粒,E气体能使湿润的红色石蕊试纸变蓝色其中A~E五种微粒均由两种元素组成且均含10个电子,它们有如图所示的转化关系: