题目内容
一定量的稀硫酸跟过量铁粉反应,为了减缓反应速率,又不影响生产氢气的总量,可向稀硫酸中加入适量的( )
| A、CH3COONa(固体) |
| B、NH4Cl(固体) |
| C、CuSO4(溶液) |
| D、Ba(OH)2(固体) |
考点:化学反应速率的影响因素
专题:化学反应速率专题
分析:Fe过量,为了减缓反应速率,且不影响生成氢气的总量,可减小氢离子的浓度,但不能改变氢离子的物质的量,以此来解答.
解答:
解:A.加CH3COONa(s),与硫酸反应生成醋酸,氢离子浓度减小,物质的量不变,则减缓反应速率,且不影响生成氢气的总量,故A正确;
B.加NH4Cl(s),在溶液中水解生成氢离子,则生成氢气增多,故B错误;
C.加入硫酸铜,铁置换出铜,形成原电池反应,反应速率增大,故C错误;
D.加入Ba(OH)2固体,与硫酸反应,氢气总量减少,故D错误.
故选A.
B.加NH4Cl(s),在溶液中水解生成氢离子,则生成氢气增多,故B错误;
C.加入硫酸铜,铁置换出铜,形成原电池反应,反应速率增大,故C错误;
D.加入Ba(OH)2固体,与硫酸反应,氢气总量减少,故D错误.
故选A.
点评:本题考查影响反应速率的因素,为高考常考考点,注意Fe过量,生成氢气由硫酸决定,把握浓度对反应速率的影响即可解答,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
有关AgCl沉淀的溶解平衡说法正确的是( )
| A、AgCl沉淀生成和沉淀溶解不断进行,但速率相等 |
| B、AgCl难溶于水,溶液中没有Ag+和Cl- |
| C、升高温度,AgCl沉淀的溶解度减小 |
| D、向AgCl沉淀中加入NaCl固体,AgCl沉淀不变 |
下列关于某溶液中所含离子的检验,判断正确的是( )
| A、加入AgNO3溶液,生成白色沉淀,再加入稀盐酸,沉淀不溶解,可确定有Cl-存在 |
| B、用洁净铂丝蘸取该溶液在火焰上灼烧,产生黄色火焰,则原溶液中一定含有Na+ |
| C、加入HCl溶液,生成无色无味气体,该气体能使澄清石灰水变浑浊,则原溶液中一定含有CO32- |
| D、加入Ba(NO3)2溶液,生成白色沉淀,加稀盐酸沉淀不溶解,可确定有SO42-存在 |
可逆反应:2NO2?2NO+O2在体积固定的密闭容器中进行,达到平衡状态的标志是( )
①单位时间内生成nmolO2的同时生成2nmolNO
②单位时间内生成nmolO2的同时生成2nmolNO2
③用NO2,NO,O2表示的反应速率的比为2:2:1的状态
④混合气体的压强不再改变的状态
⑤混合气体的密度不再改变的状态
⑥混合气体的平均相对分子质量不再改变的状态
⑦混合气体的颜色不再改变的状态.
①单位时间内生成nmolO2的同时生成2nmolNO
②单位时间内生成nmolO2的同时生成2nmolNO2
③用NO2,NO,O2表示的反应速率的比为2:2:1的状态
④混合气体的压强不再改变的状态
⑤混合气体的密度不再改变的状态
⑥混合气体的平均相对分子质量不再改变的状态
⑦混合气体的颜色不再改变的状态.
| A、②④⑥⑦ | B、②③⑤⑦ |
| C、①③④⑤ | D、全部 |
 某温度下在2L密闭容器中加入一定量A,发生以下化学反应:2A(g)═B(g)+C(g);△H=-48.25kJ?mol-1反应过程中B、A的浓度比与时间t有如图所示关系,若测得第15min时c(B)=1.6mol?L-1,下列结论正确的是( )
某温度下在2L密闭容器中加入一定量A,发生以下化学反应:2A(g)═B(g)+C(g);△H=-48.25kJ?mol-1反应过程中B、A的浓度比与时间t有如图所示关系,若测得第15min时c(B)=1.6mol?L-1,下列结论正确的是( )| A、该温度下此反应的平衡常数为3.2 |
| B、A的初始物质的量为4 mol |
| C、反应到达平衡时,放出的热量是193kJ |
| D、反应达平衡时,A的转化率为80% |
下图装置能组成原电池的是( )
A、 |
B、 |
C、 |
D、 |
蓄电池是一种可以反复充电、放电的装置.有一种蓄电池在充电和放电时发生的反应为:NiO2+Fe+2H2O
Fe(OH)2+Ni(OH)2.下列有关该电池的说法中正确的是( )
| 放电 |
| 充电 |
| A、放电时电解质溶液显强酸性 |
| B、充电时阳板反应为Ni(OH)2+2OH--2e-=NiO2+2H2O |
| C、放电时正极附近溶液pH减小 |
| D、充电时阴极附近溶液的碱性保持不变 |
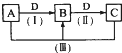 A、B、C、D都是中学化学常见的物质,其中A、B、C均含有同一种元素.在一定条件下相互转化的关系如图所示.请回答下列问题.
A、B、C、D都是中学化学常见的物质,其中A、B、C均含有同一种元素.在一定条件下相互转化的关系如图所示.请回答下列问题.