题目内容
实验室里通常用MnO2与浓盐酸反应制取氯气,其反应的化学方程式为:MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O
(1)在该反应中,如有1mol Cl2生成,被氧化的HCl的物质的量是 mol,转移电子的物质的量是 mol.
(2)某温度下,将Cl2通入NaOH溶液中,反应得到含有ClO-与ClO3-物质的量之比为1:1的混合液,反应的化学方程式是 .
(3)报纸报道了多起卫生间清洗时,因混合使用“洁厕灵”(主要成分是盐酸)与“84消毒液”(主要成分是NaClO)发生氯气中毒的事件.试根据你的化学知识分析,原因是(用离子方程式表示) .
| ||
(1)在该反应中,如有1mol Cl2生成,被氧化的HCl的物质的量是
(2)某温度下,将Cl2通入NaOH溶液中,反应得到含有ClO-与ClO3-物质的量之比为1:1的混合液,反应的化学方程式是
(3)报纸报道了多起卫生间清洗时,因混合使用“洁厕灵”(主要成分是盐酸)与“84消毒液”(主要成分是NaClO)发生氯气中毒的事件.试根据你的化学知识分析,原因是(用离子方程式表示)
考点:氯气的实验室制法,氯、溴、碘及其化合物的综合应用
专题:卤族元素
分析:(1)依据MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O,反应中由4mol氯化氢参加反应,其中2mol表现为酸性,2mol表现为还原性,被氧化;
(2)依据原子个数守恒和氧化还原反应中得失电子守恒解答;
(3)NaClO中氯元素处于+1价,具有强的氧化性,氯化氢中氯元素处于-1价,具有还原性,次氯酸钠与盐酸发生氧化还原反应生成有毒气体氯气.
| ||
(2)依据原子个数守恒和氧化还原反应中得失电子守恒解答;
(3)NaClO中氯元素处于+1价,具有强的氧化性,氯化氢中氯元素处于-1价,具有还原性,次氯酸钠与盐酸发生氧化还原反应生成有毒气体氯气.
解答:
解:(1)根据方程式MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O,可知盐酸在反应中既表现还原性又表现酸性,4mol氯化氢参加反应,只有2mol氯化氢中-1价的氯离子失去2mol电子,被氧化为氯气中的0价的氯原子,生成1mol氯气,另外2mol氯化氢表现为酸性;
故答案为:2;2;
(2)Cl2通入NaOH溶液中,反应得到含有ClO-与ClO3-物质的量之比为1:1的溶液,氯元素的化合价升高为+1价和+5价,依据氧化还原反应的规律,所以产物肯定含有氯化钠,此时氯元素的化合价降低,依据ClO-与ClO3-物质的量之比为1:1,设NaClO3和NaClO的系数都是1,则发生的反应为:4Cl2+8NaOH=6NaCl+NaClO3+NaClO+4H2O,
故答案为:4Cl2+8NaOH=6NaCl+NaClO3+NaClO+4H2O;
(3)次氯酸钠与盐酸发生氧化还原反应生成有毒气体氯气,离子反应方程式为:Cl-+ClO-+2H+═Cl2↑+H2O,
故答案为:Cl-+ClO-+2H+═Cl2↑+H2O.
| ||
故答案为:2;2;
(2)Cl2通入NaOH溶液中,反应得到含有ClO-与ClO3-物质的量之比为1:1的溶液,氯元素的化合价升高为+1价和+5价,依据氧化还原反应的规律,所以产物肯定含有氯化钠,此时氯元素的化合价降低,依据ClO-与ClO3-物质的量之比为1:1,设NaClO3和NaClO的系数都是1,则发生的反应为:4Cl2+8NaOH=6NaCl+NaClO3+NaClO+4H2O,
故答案为:4Cl2+8NaOH=6NaCl+NaClO3+NaClO+4H2O;
(3)次氯酸钠与盐酸发生氧化还原反应生成有毒气体氯气,离子反应方程式为:Cl-+ClO-+2H+═Cl2↑+H2O,
故答案为:Cl-+ClO-+2H+═Cl2↑+H2O.
点评:本题考查了氯气的性质及氧化还原方程式、离子方程是的书写,题目难度不大,掌握氧化还原反应的规律,明确含氯化合物的性质是解题的关键.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
下列说法正确的是( )
| A、c(H+)=0.1mol/L的甲酸溶液中,HCOO-和H+ 数目之和为0.1 NA |
| B、通常情况下,溴是液态,碘是固态,所以I-I键比Br-Br弱 |
| C、将稀氨水逐滴加入稀硫酸中,当溶液pH=7时,2C(NH4+)=C(SO42-) |
D、合成顺丁橡胶( )的单体是CH2=CH-CH=CH2 )的单体是CH2=CH-CH=CH2 |
化学与人类生活密切相关,下列与化学有关的说法正确的是( )
| A、化学药品着火,都要立即用水或泡沫灭火器灭火 |
| B、开发和推广新能源是实现低碳生活的途径之一 |
| C、食品包装袋中常放入小袋的生石灰,目的是防止食品氧化变质 |
| D、纤维素在人体内可水解为葡萄糖,故可作人类的营养物质 |
下列元素中属于短周期元素的是( )
| A、碘 | B、铁 | C、钙 | D、氩 |

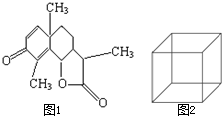 (1)图1是一种驱蛔虫药--山道年的结构简式,试确定其分子式为:
(1)图1是一种驱蛔虫药--山道年的结构简式,试确定其分子式为: 如图所示,是一个原电池装置.它将
如图所示,是一个原电池装置.它将 有A、B、C、D、E五种元素(A、B、C、D、E分别代表元素符号),其中A元素原子核内只有一个质子;B元素的基态原子s亚层的总电子数比p亚层的总电子数多1;C元素的原子最外层电子数是次外层电子数的3倍;D位于B的下一周期,在同周期元素形成的简单离子中,D形成的简单离子半径最小;E的基态原子中电子排布在三个能级上,且这三个能级所含电子数均相同.
有A、B、C、D、E五种元素(A、B、C、D、E分别代表元素符号),其中A元素原子核内只有一个质子;B元素的基态原子s亚层的总电子数比p亚层的总电子数多1;C元素的原子最外层电子数是次外层电子数的3倍;D位于B的下一周期,在同周期元素形成的简单离子中,D形成的简单离子半径最小;E的基态原子中电子排布在三个能级上,且这三个能级所含电子数均相同.