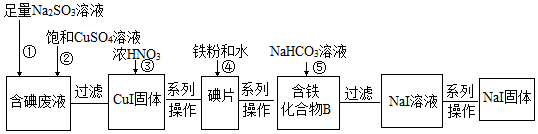
题目内容
6.氢化亚铜(CuH)是一种难溶物质,具有的性质有:不稳定,易分解;在氯气中能燃烧;与稀盐酸反应能生成气体;Cu+在酸性条件下发生的反应是:2Cu+═Cu2++Cu.根据以上信息,下列叙述正确的是( )| A. | 用CuSO4溶液和“另一物质”制CuH的反应中,用氧化还原观点分析,这“另一物质”在反应中作氧化剂 | |
| B. | CuH在氯气中燃烧的化学反应方程式为2CuH+3Cl2 $\frac{\underline{\;点燃\;}}{\;}$2CuCl2+2HCl | |
| C. | CuH溶解在稀盐酸中生成的气体是氯气 | |
| D. | 如果选项C反应中生成了标准状况下22.4 L的气体,则转移电子3 mol |
分析 A.根据化合价的变化判断氧化剂、还原剂;
B.CuH在氯气中燃烧,氯气做氧化剂,CuH做还原剂;
C.CuH溶解在稀盐酸中,CuH中的H-失电子,盐酸中H+得电子,据此分析;
D.因为Cu+在酸性条件下还发生的反应2Cu+═Cu2++Cu,又CuH中的H-失电子,盐酸中H+得电子,所以发生的总反应为:2CuH+2H+=Cu2++Cu+2H2↑,据此分析计算.
解答 解:A.用CuSO4溶液和“另一物质”制CuH的反应中,Cu化合价降低则CuSO4做氧化剂,所以另一物质做还原剂,故A错误;
B.CuH在氯气中燃烧,氯气做氧化剂,CuH做还原剂,所以反应方程式为:2CuH+3Cl2 $\frac{\underline{\;点燃\;}}{\;}$2CuCl2+2HCl,故B正确;
C.CuH溶解在稀盐酸中,CuH中的H-失电子,盐酸中H+得电子,所以得到的气体是H2,故C错误;
D.因为Cu+在酸性条件下还发生的反应2Cu+═Cu2++Cu,又CuH中的H-失电子,盐酸中H+得电子,所以发生的总反应为:2CuH+2H+=Cu2++Cu+2H2↑,则生成1mol氢气转移1.5mol电子,故生成了标准状况下22.4 L的气体,则转移电子1.5 mol,故D错误;
故选:B.
点评 本题属于信息题,考查学生分析问题的能力,筛选有用信息结合已学知识进行整合处理,涉及氧化还原的知识,但难度不大.

练习册系列答案
 快捷英语周周练系列答案
快捷英语周周练系列答案
相关题目
17.下列有关纯净物、混合物、电解质、非电解质的正确组合为( )
| 选项 | 纯净物 | 混合物 | 电解质 | 非电解质 |
| A | 纯盐酸 | 淀粉溶液 | 硫酸 | 液氨 |
| B | 漂粉精 | 水玻璃 | 氧化铝 | 二氧化硫 |
| C | 胆矾 | 氢氧化铁胶体 | 碳酸钠 | 乙醇 |
| D | 水银 | 澄清石灰水 | 氯化铜 | 铁 |
| A. | A | B. | B | C. | C | D. | D |
14.铁的合金是当今世界使用量最大的合金,下列关于铁及其化合物的说法正确的是( )
| A. | 铁的氧化物都具有磁性 | |
| B. | 氢氧化亚铁在空气中加热会分解生成氧化亚铁和水蒸气 | |
| C. | 铁在空气中放置表面会生成致密的氧化膜从而阻止铁被继续腐蚀 | |
| D. | 四氧化三铁可以通过置换反应或化合反应制备 |
1.25℃时,某浓度的氯化铵溶液的pH=4,下列叙述中不正确的是( )
| A. | 溶液中水电离出的c(OH-)=1×10-10 mol•L-1 | |
| B. | 溶液中的c(Cl-)>c(NH4+)>c(H+)>c(OH-) | |
| C. | 溶液中的c(H+)+c(NH4+)=c(Cl-)+c(OH-) | |
| D. | 溶液中的c(NH3•H2O)=c(NH4+) |
11.下列叙述及评价均合理的是( )
| 选项 | 叙述 | 评价 |
| A | 含18O的乙醇和乙酸反应制备乙酸乙酯则反应后18O存在于任何物质中 | 对,因为此反应为可逆反应 |
| B | 往苯酚钠溶液中通入CO2,可制备得到苯酚,并得到碳酸氢钠 | 对,根据强酸制弱酸的规律,碳酸的酸性比苯酚的酸性强,故可用此反应制备苯酚 |
| C | 向卤代烃水解后的溶液中直接加入AgNO3溶液,根据沉淀颜色可以判断卤素原子种类 | 对,水解后溶液中有卤化氢,与AgNO3溶液反应生成卤化银沉淀 |
| D | 用酸性高锰酸钾溶液除去甲烷中的乙烯气体 | 对,乙烯能与酸性高锰酸钾溶液反应,而甲烷不能与高锰酸钾溶液反应. |
| A. | A | B. | B | C. | C | D. | D |
18.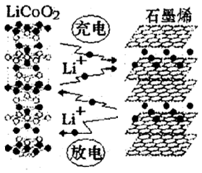 2016年12月1日,华为宣布:利用锂离子能在石墨烯表面和电极之间快速大量穿梭运动的特性,开发出石墨烯电池,电池反应式为LixC6+Li1-xCoO2 $?_{充电}^{放电}$C6+LiCoO2,其工作原理如图.下列关于该电池的说法正确的是( )
2016年12月1日,华为宣布:利用锂离子能在石墨烯表面和电极之间快速大量穿梭运动的特性,开发出石墨烯电池,电池反应式为LixC6+Li1-xCoO2 $?_{充电}^{放电}$C6+LiCoO2,其工作原理如图.下列关于该电池的说法正确的是( )
 2016年12月1日,华为宣布:利用锂离子能在石墨烯表面和电极之间快速大量穿梭运动的特性,开发出石墨烯电池,电池反应式为LixC6+Li1-xCoO2 $?_{充电}^{放电}$C6+LiCoO2,其工作原理如图.下列关于该电池的说法正确的是( )
2016年12月1日,华为宣布:利用锂离子能在石墨烯表面和电极之间快速大量穿梭运动的特性,开发出石墨烯电池,电池反应式为LixC6+Li1-xCoO2 $?_{充电}^{放电}$C6+LiCoO2,其工作原理如图.下列关于该电池的说法正确的是( )| A. | 该电池若用隔膜可选用质子交换膜 | |
| B. | 放电时,LiCoO2极发生的电极反应为:LiCoO2-xe-═Li1-xCoO2+xLi+ | |
| C. | 石墨烯电池的优点是提高电池的储铿容量进而提高能量密度 | |
| D. | 废旧的该电池进行“放电处理”让Li+嵌入石墨烯中而有利于回收 |
15.下列反应的离子方程式书写不正确的是( )
| A. | 稀硫酸与氢氧化钾溶液反应:H++OH-═H2O | |
| B. | 过氧化钠与水反应:2Na2O 2+2H2O═4Na++4OH-+O2↑ | |
| C. | 氧化铁溶于盐酸:Fe2O3+6H+═2Fe3++3H2O | |
| D. | Na与硫酸铜溶液反应:2Na+Cu2+═2Na++Cu |
16.下列关于有机物的说法正确的是( )
| A. | 皂化反应的产物是高级脂肪酸和甘油 | |
| B. | 酯化反应和酯的水解反应均为取代反应 | |
| C. | 将苯与浓溴水混合可制取溴苯 | |
| D. | 新戊烷和2-甲基丁烷是同一种物质 |