题目内容
12.体积相同且pH均为1的HCl、H2SO4、CH3COOH中分别加入过量的Mg.下列叙述中错误的是( )| A. | 开始瞬间HCl、H2SO4、CH3COOH反应速率相等 | |
| B. | 至反应结束时CH3COOH中放出H2的总量最多 | |
| C. | 收集相同体积的H2的CH3COOH所用时间最长 | |
| D. | 至反应结束时HCl、H2SO4收集到H2的体积相同 |
分析 A.反应速率与氢离子浓度成正比;
B.酸最终电离出的氢离子物质的量越多,生成的氢气总量越多;
C.离子浓度越小,反应速率越小,收集相同体积的氢气所用时间越长;
D.酸最终电离出的氢离子物质的量相同时,生成的氢气体积相同.
解答 解:HCl、H2SO4是强电解质而CH3COOH是弱电解质,相同pH的这三种酸浓度关系为c(CH3COOH)>c(HCl)=2c(H2SO4),相同pH、相同体积的这三种酸分别与足量Mg反应,最终电离出n(H+)大小顺序是HCl=H2SO4<CH3COOH,
A.反应速率与氢离子浓度成正比,开始时氢离子浓度相同,所以反应速率相同,故A正确;
B.酸最终电离出的氢离子物质的量越多,生成的氢气总量越多,最终醋酸电离出的n(H+)大,则最终醋酸生成的氢气多,故B正确;
C.离子浓度越小,反应速率越小,收集相同体积的氢气所用时间越长,反应中中醋酸继续电离出氢离子,而HCl、硫酸不再电离出氢离子,所以反应过程中醋酸中氢离子浓度大于盐酸和硫酸,则反应过程中醋酸反应速率大,收集相同体积的H2的CH3COOH所用时间最短,故C错误;
D.酸最终电离出的氢离子物质的量相同时,生成的氢气体积相同,最终电离出n(H+)盐酸和硫酸中相等,所以反应结束时HCl、H2SO4收集到H2的体积相同,故D正确;
故选C.
点评 本题考查弱电解质的电离,侧重考查学生分析判断能力,明确弱电解质电离特点及影响反应速率因素是解本题关键,注意:化学反应速率与离子浓度成正比,与电解质强弱无关,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
12.用硫酸酸化的草酸(H2C2O4,二元弱酸)溶液能将KMnO4溶液中的MnO4-转化为Mn2+.某化学小组研究发现,少量MnSO4可对该反应起催化作用.为进一步研究有关因素对该反应速率的影响,探究如下:
(1)常温下,控制KMnO4溶液初始浓度相同,调节不同的初始pH和草酸溶液用量,做对比实验,请完成以下实验设计表.
表中a、b的值分别为:a=50、b=10
(2)该反应的离子方程式5H2C2O4+2MnO4-+6H+=10CO2↑+2Mn2++8H2O.
(3)若t1<t2,则根据实验①和②得到的结论是溶液的pH对该反应的速率有影响.
(4)请你设计实验④验证MnSO4对该反应起催化作用,完成表中内容.
(5)某化学小组用滴定法测定KMnO4溶液物质的量浓度:取W g草酸晶体(H2C2O4•2H2O,其摩尔质量126g/mol)溶于水配成250mL溶液,取25.00mL溶液置于锥形瓶中,加入适量稀H2SO4酸化,再用KMnO4溶液滴定至终点,重复滴定两次,平均消耗KMnO4溶液
V mL.请回答下列问题:
①该测定方法中不需要(填“需要”或“不需要”)加入指示剂;
②计算得KMnO4溶液的c(KMnO4)=$\frac{20w}{63V}$ mol/L.(请写出最后化简结果)
(1)常温下,控制KMnO4溶液初始浓度相同,调节不同的初始pH和草酸溶液用量,做对比实验,请完成以下实验设计表.
| 实验 编号 | 温度 | 初始pH | 0.1mol/L 草酸溶液/mL | 0.01mol/L KMnO4溶的 体积/mL | 蒸馏水 体积/mL | 待测数据(反应混合液褪色 时间/s) |
| ① | 常温 | 1 | 20 | 50 | 30 | t1 |
| ② | 常温 | 2 | 20 | 50 | 30 | t2 |
| ③ | 常温 | 2 | 40 | a | b | t3 |
(2)该反应的离子方程式5H2C2O4+2MnO4-+6H+=10CO2↑+2Mn2++8H2O.
(3)若t1<t2,则根据实验①和②得到的结论是溶液的pH对该反应的速率有影响.
(4)请你设计实验④验证MnSO4对该反应起催化作用,完成表中内容.
| 实验方案(不要求写出具体操作过程) | 预期实验结果和结论 |
| 若反应混合液褪色时间小于实验①中的t1,则MnSO4对该反应起催化作用(若褪色时间相同,则MnSO4对该反应无催化作用) |
V mL.请回答下列问题:
①该测定方法中不需要(填“需要”或“不需要”)加入指示剂;
②计算得KMnO4溶液的c(KMnO4)=$\frac{20w}{63V}$ mol/L.(请写出最后化简结果)
3.铬铁矿的主要成分可表示为FeO•Cr2O3,还含有MgO、Al2O3、Fe2O3等杂质,以下是以铬铁矿为原料制备重铬酸钾(K2Cr2O7)的流程图:
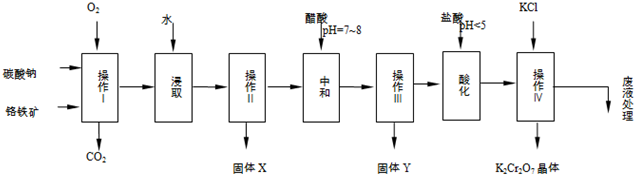
已知:①4FeO•Cr2O3+8Na2CO3+7O2$\stackrel{一定条件}{→}$8Na2CrO4+2Fe2O3+8CO2↑;
②Na2CO3+Al2O3$\stackrel{一定条件}{→}$2NaAlO2+CO2↑;
根据题意回答下列问题:
(1)操作I在常温下该反应速度极慢,下列措施中能使反应速率增大的是AC.
A.升高温度 B.增加纯碱的用量 C.将原料粉碎
(2)固体X中主要含有Fe2O3、MgO(填写化学式);
(3)酸化步骤用盐酸调节溶液pH<5,使含铬物质发生了转化,请写出其离子反应方程式2CrO42-+2H+=Cr2O72-+H2O.
(4)操作Ⅳ由多步组成,获得K2Cr2O7晶体的操作依次是:加入KCl固体、蒸发浓缩、冷却结晶、过滤、洗涤、干燥.
(5)表是相关物质的溶解度数据,操作Ⅲ发生反应的化学方程式是:Na2Cr2O7+2KCl→K2Cr2O7↓+2NaCl.该反应在溶液中能发生的理由是K2Cr2O7的溶解度比Na2Cr2O7小(或四种物质中K2Cr2O7的溶解度最小).(文字说明)
(6)副产品Y主要含氢氧化铝,还含少量其它难溶杂质,精确分析Y中氢氧化铝含量的方法是称取n g样品,加入过量NaOH溶液、溶解、过滤、取滤液,在其中通入过量二氧化碳、…灼烧、冷却、称量,得干燥固体m g.计算样品中氢氧化铝的质量分数为$\frac{26m}{17n}$(用含m、n的代数式表示).

已知:①4FeO•Cr2O3+8Na2CO3+7O2$\stackrel{一定条件}{→}$8Na2CrO4+2Fe2O3+8CO2↑;
②Na2CO3+Al2O3$\stackrel{一定条件}{→}$2NaAlO2+CO2↑;
根据题意回答下列问题:
(1)操作I在常温下该反应速度极慢,下列措施中能使反应速率增大的是AC.
A.升高温度 B.增加纯碱的用量 C.将原料粉碎
(2)固体X中主要含有Fe2O3、MgO(填写化学式);
(3)酸化步骤用盐酸调节溶液pH<5,使含铬物质发生了转化,请写出其离子反应方程式2CrO42-+2H+=Cr2O72-+H2O.
(4)操作Ⅳ由多步组成,获得K2Cr2O7晶体的操作依次是:加入KCl固体、蒸发浓缩、冷却结晶、过滤、洗涤、干燥.
(5)表是相关物质的溶解度数据,操作Ⅲ发生反应的化学方程式是:Na2Cr2O7+2KCl→K2Cr2O7↓+2NaCl.该反应在溶液中能发生的理由是K2Cr2O7的溶解度比Na2Cr2O7小(或四种物质中K2Cr2O7的溶解度最小).(文字说明)
| 物质 | 溶解度/(g/100g水) | ||
| 0°C | 40°C | 80°C | |
| KCl | 28 | 40.1 | 51.3 |
| NaCl | 35.7 | 36.4 | 38 |
| K2Cr2O7 | 4.7 | 26.3 | 73 |
| Na2Cr2O7 | 163 | 215 | 376 |
20.在蛋白质中加入下列物质,发生盐析的是( )
| A. | 饱和食盐水 | B. | 硫酸铜溶液 | C. | 浓硫酸 | D. | 酒精 |
17.用98%浓硫酸配制2mol/L的稀硫酸,下列情况会使所配溶液浓度偏低的是( )
| A. | 未冷却就转移、定容 | B. | 容量瓶原有少量蒸馏水 | ||
| C. | 定容时俯视刻度线观察液面 | D. | 量筒取浓盐酸时,俯视读数 |
1.下列变化属于还原反应的是( )
| A. | Fe-→FeSO4 | B. | NaCl-→AgCl | C. | CO-→CO2 | D. | Cu(NO3)2-→Cu |
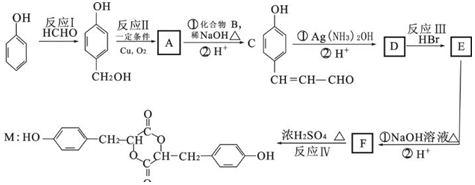
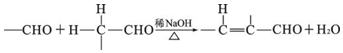
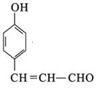 +2Ag(NH3)2OH$\stackrel{△}{→}$
+2Ag(NH3)2OH$\stackrel{△}{→}$ +2Ag↓+3NH3+H2O
+2Ag↓+3NH3+H2O 种.
种. .
.