题目内容
a、b、c、d、f五种前四周期元素,原子序数依次增大;a、b、c三种元素的基态原子具有相同的能层和能级,第一电离能I1(a)<I1(c)<I1(b),且其中基态b原子的2p轨道处于半充满状态;d为周期表前四周期中电负性最小的元素;f的原子序数为29.请回答下列问题.(如需表示具体元素请用相应的元素符号)
(1)写出ac2的电子式 ;基态f原子的外围电子排布式为 .
(2)写出一种与ac2互为等电子体的物质的化学式 .
(3)b的简单氢化物的沸点比同族元素氢化物的沸点 .(填“高”或“低”)
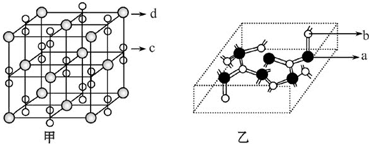
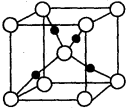
(4)化合物M由c、d两种元素组成,其晶胞结构如甲,则M的化学式为 .
(5)化合物N的部分结构如乙,N由a、b两元素组成,则硬度超过金刚石.试回答:
①N的晶体类型为 ,其硬度超过金刚石的原因是 .
②N晶体中a、b两元素原子的杂化方式均为 .
(1)写出ac2的电子式
(2)写出一种与ac2互为等电子体的物质的化学式
(3)b的简单氢化物的沸点比同族元素氢化物的沸点

(4)化合物M由c、d两种元素组成,其晶胞结构如甲,则M的化学式为
(5)化合物N的部分结构如乙,N由a、b两元素组成,则硬度超过金刚石.试回答:
①N的晶体类型为
②N晶体中a、b两元素原子的杂化方式均为
考点:位置结构性质的相互关系应用,晶胞的计算
专题:元素周期律与元素周期表专题
分析:a、b、c、d、f五种前四周期元素,原子序数依次增大;基态b原子的2p轨道处于半充满状态,则原子核外电子排布式为1s22s22p3,b为N元素;a、b、c三种元素的基态原子具有相同的能层和能级,均处于第二周期,第一电离能I1(a)<I1(c)<I1(b),且原子序数a<b<c,则c为O元素、a为C元素;d为周期表前四周期中电负性最小的元素,则d为K元素;f的原子序数为29,则f为Cu,据此解答.
解答:
解:a、b、c、d、f五种前四周期元素,原子序数依次增大;基态b原子的2p轨道处于半充满状态,则原子核外电子排布式为1s22s22p3,b为N元素;a、b、c三种元素的基态原子具有相同的能层和能级,均处于第二周期,第一电离能I1(a)<I1(c)<I1(b),且原子序数a<b<c,则c为O元素、a为C元素;d为周期表前四周期中电负性最小的元素,则d为K元素;f的原子序数为29,则f为Cu,
(1)CO2电子式为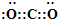 ,基态Cu原子核外电子排布式为:1s22s22p63s23p63d104s1,外围电子排布式为3d104s1,
,基态Cu原子核外电子排布式为:1s22s22p63s23p63d104s1,外围电子排布式为3d104s1,
故答案为: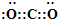 ; 3d104s1;
; 3d104s1;
(2)与CO2互为等电子体的物质的化学式为:N2O等,
故答案为:N2O等;
(3)b的简单氢化物为NH3,NH3分子之间存在氢键,沸点比同族元素氢化物,
故答案为:高;
(4)晶胞中K离子位于晶胞的顶点和体心位置,1个晶胞含有K离子的个数为8×
+6×
=4,晶胞中,由O元素构成的离子个数为:2×(12×
+1)=8,则甲的化学式为KO2,
故答案为:KO2;
(5)①化合物N由C、N两元素组成,硬度超过金刚石,则N为原子晶体,由于C-N键的键长小于C-C键,键能大于C-C键,则硬度超过金刚石,
故答案为:原子晶体;C-N键的键长小于C-C键,键能大于C-C键;
②晶体中C原子与4个N原子成键,N原子与3个C原子成键,并均有1对孤电子对,都为sp3杂化,
故答案为:sp3.
(1)CO2电子式为
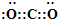 ,基态Cu原子核外电子排布式为:1s22s22p63s23p63d104s1,外围电子排布式为3d104s1,
,基态Cu原子核外电子排布式为:1s22s22p63s23p63d104s1,外围电子排布式为3d104s1,故答案为:
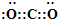 ; 3d104s1;
; 3d104s1;(2)与CO2互为等电子体的物质的化学式为:N2O等,
故答案为:N2O等;
(3)b的简单氢化物为NH3,NH3分子之间存在氢键,沸点比同族元素氢化物,
故答案为:高;
(4)晶胞中K离子位于晶胞的顶点和体心位置,1个晶胞含有K离子的个数为8×
| 1 |
| 8 |
| 1 |
| 2 |
| 1 |
| 3 |
故答案为:KO2;
(5)①化合物N由C、N两元素组成,硬度超过金刚石,则N为原子晶体,由于C-N键的键长小于C-C键,键能大于C-C键,则硬度超过金刚石,
故答案为:原子晶体;C-N键的键长小于C-C键,键能大于C-C键;
②晶体中C原子与4个N原子成键,N原子与3个C原子成键,并均有1对孤电子对,都为sp3杂化,
故答案为:sp3.
点评:本题是对物质结构的考查,涉及电子式、核外电子排布式、等电子体、氢键、杂化轨道、晶胞的计算及晶体的性质等,题目难度中等,需要学生具备扎实的基础,注意杂化类型的判断.

练习册系列答案
 尖子生新课堂课时作业系列答案
尖子生新课堂课时作业系列答案
相关题目
下列物质中不属于离子化合物的是( )
| A、KCl |
| B、Ba(OH)2 |
| C、H2O |
| D、NH4Cl |
金刚石和石墨是碳元素的两种结构不同的单质.在100kPa时,1mol石墨转化为金刚石,要吸收1.895kJ的能量.下列说法不正确的是( )
| A、石墨比金刚石稳定 |
| B、金刚石与石墨中的化学性质相似 |
| C、1mol金刚石比1mol石墨的总能量高 |
| D、1mol石墨和金刚石完全燃烧时释放的能量石墨比金刚石多 |
对可逆反应4NH3(g)+5O2(g)?4NO(g)+6H2O(g),下列叙述正确的是( )
| A、达到化学平衡时,υ正=υ逆=0 |
| B、若单位时间内生成x mol NO的同时,消耗x mol NH3,则反应达到平衡状态 |
| C、达到化学平衡时,若增大容器体积,则正反应速率减少,逆反应速率增大 |
| D、达到化学反应平衡后,改变条件当υ正>υ逆,平衡向正反应方向移动 |
居室装修用石材的放射性常用
Ra作为标准,居里夫人(Marie Curie)因对Ra元素的研究两度获得诺贝尔奖.下列叙述中正确的是( )
226 88 |
| A、Ra元素位于元素周期表中第六周期ⅡA |
| B、RaSO4难溶于水和强酸 |
| C、RaCO3不能与盐酸反应 |
| D、Ra(OH)2是一种两性氢氧化物 |
 已知A、B、C、D均为前四周期元素且原子序数依次增大,元素A的基态原子2p轨道有3个未成对电子,元素B的原子最外层电子数是其内层电子数的3倍,元素C的一种常见单质为淡黄色粉末,D的内层轨道全部排满电子,且最外层电子数为l.
已知A、B、C、D均为前四周期元素且原子序数依次增大,元素A的基态原子2p轨道有3个未成对电子,元素B的原子最外层电子数是其内层电子数的3倍,元素C的一种常见单质为淡黄色粉末,D的内层轨道全部排满电子,且最外层电子数为l.