题目内容
 已知A、B、C、D均为前四周期元素且原子序数依次增大,元素A的基态原子2p轨道有3个未成对电子,元素B的原子最外层电子数是其内层电子数的3倍,元素C的一种常见单质为淡黄色粉末,D的内层轨道全部排满电子,且最外层电子数为l.
已知A、B、C、D均为前四周期元素且原子序数依次增大,元素A的基态原子2p轨道有3个未成对电子,元素B的原子最外层电子数是其内层电子数的3倍,元素C的一种常见单质为淡黄色粉末,D的内层轨道全部排满电子,且最外层电子数为l.(1)在第2周期中,第一电离能大于B的元素有
(2)A的最简单气态氢化物分子的空间构型为
(3)AB3-中A原子轨道的杂化类型是
(4)D(OH)2难溶于水,易溶于氨水,写出其溶于氨水的离子方程式
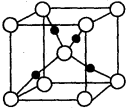
(5)D2B的晶胞如图所示,已知晶体的密度为ρ g?cm-3,阿伏加德罗常数为NA,则晶胞边长为
考点:位置结构性质的相互关系应用,晶胞的计算
专题:元素周期律与元素周期表专题,化学键与晶体结构
分析:A、B、C、D均为前四周期元素且原子序数依次增大,元素A的基态原子2p轨道有3个未成对电子,核外电子排布为1s22s22p3,则A为N元素;元素B的原子最外层电子数是其内层电子数的3倍,原子只能有2个电子层,最外层电子数为6,则B为O元素;元素C的一种常见单质为淡黄色粉末,则C为S元素;D的内层轨道全部排满电子,且最外层电子数为l,原子序数大于S,只能处于第四周期,核外电子数=2+8+18+1=29,则D为Cu元素,据此解答.
解答:
解:A、B、C、D均为前四周期元素且原子序数依次增大,元素A的基态原子2p轨道有3个未成对电子,核外电子排布为1s22s22p3,则A为N元素;元素B的原子最外层电子数是其内层电子数的3倍,原子只能有2个电子层,最外层电子数为6,则B为O元素;元素C的一种常见单质为淡黄色粉末,则C为S元素;D的内层轨道全部排满电子,且最外层电子数为l,原子序数大于S,只能处于第四周期,核外电子数=2+8+18+1=29,则D为Cu元素,
(1)同周期随原子序数增大,元素第一电离能呈增大趋势,但氮元素原子2p轨道容纳3个电子,为半满稳定状态,能量较低,第一电离能高于O元素,高于第二周期中N、F、Ne的第一电离能都高于O元素,
故答案为:3;
(2)A的最简单气态氢化物为NH3,分子的空间构型为三角锥形;水分子与乙醇分子之间形成氢键,故H2O在乙醇中的溶解度大于H2S,
故答案为:三角锥形;水分子与乙醇分子之间形成氢键;
(3)NO3-中N原子价层电子对数=3+
=3,N原子轨道的杂化类型是sp2,与NO3-互为等电子体微粒的化学式为SO3、CO32-等,
故答案为:sp2;SO3、CO32-等;
(4)Cu(OH)2难溶于水,易溶于氨水,其溶于氨水的离子方程式为:Cu(OH)2+4NH3.H2O=[Cu(NH3)4]2++2OH-+4H2O,
故答案为:Cu(OH)2+4NH3.H2O=[Cu(NH3)4]2++2OH-+4H2O;
(5)Cu2O的晶胞中黑色球数目=4、白色球数目=2+8×
=2,故黑色球为Cu、白色球为O,晶胞质量=2×
g,晶体的密度为ρ g?cm-3,则晶胞体积=
=
cm3,则晶胞边长=
cm,
故答案为:
.
(1)同周期随原子序数增大,元素第一电离能呈增大趋势,但氮元素原子2p轨道容纳3个电子,为半满稳定状态,能量较低,第一电离能高于O元素,高于第二周期中N、F、Ne的第一电离能都高于O元素,
故答案为:3;
(2)A的最简单气态氢化物为NH3,分子的空间构型为三角锥形;水分子与乙醇分子之间形成氢键,故H2O在乙醇中的溶解度大于H2S,
故答案为:三角锥形;水分子与乙醇分子之间形成氢键;
(3)NO3-中N原子价层电子对数=3+
| 5+1-2×3 |
| 2 |
故答案为:sp2;SO3、CO32-等;
(4)Cu(OH)2难溶于水,易溶于氨水,其溶于氨水的离子方程式为:Cu(OH)2+4NH3.H2O=[Cu(NH3)4]2++2OH-+4H2O,
故答案为:Cu(OH)2+4NH3.H2O=[Cu(NH3)4]2++2OH-+4H2O;
(5)Cu2O的晶胞中黑色球数目=4、白色球数目=2+8×
| 1 |
| 8 |
| 64×2+16 |
| NA |
2×
| ||
| ρ g?cm-3 |
| 288 |
| ρ NA |
| 3 |
| ||
故答案为:
| 3 |
| ||
点评:本题是对物质结构的考查,涉及电离能、分子结构、杂化轨道、等电子体、配合物、晶胞计算等,推断元素是解题关键,需要学生具备扎实的基础,难度中等.

练习册系列答案
 巧学巧练系列答案
巧学巧练系列答案 课课练江苏系列答案
课课练江苏系列答案
相关题目
下列说法不正确的是( )
| A、氨基酸是生命的基础,蛋白质是氨基酸的基石 |
| B、油脂碱性水解又称为皂化反应,因为油脂碱性水解后的产物为高级脂肪酸钠 |
| C、碘有“智力元素”之称,因为它是神经系统发育所不可缺少的 |
| D、维生素C药片的外面常包裹一层糖衣,因为维生素C具有还原性,易被氧化 |
从植物花中可提取一种简写为HIn的有机物,它在水溶液中因存在下列平衡:HIn(溶液,红色)?H+(溶液)+In-(溶液,黄色) 而用作酸碱指示剂.往该溶液中加入纯碱粉末,则溶液颜色为( )
| A、黄色变浅 | B、红色变深 |
| C、褪为无色 | D、黄色变深 |
纳米Cu2O是一种用途广泛的光电材料,可用如下两种电化学装置制备这种材料,下列有关说法中正确的是( )


| A、阳极上的电极反应均为2Cu-2e-+2OH-═Cu2O+H2O |
| B、工作过程中两个装置内溶液的pH均减小 |
| C、两个装置内阴离子均移向铜电极 |
| D、阴极上开始时均有氢气生成 |

 汽车作为一种现代交通工具正在进入千家万户,汽车尾气中含有CO、NO2等有毒气体,其污染问题也成为当今社会急需解决的问题.
汽车作为一种现代交通工具正在进入千家万户,汽车尾气中含有CO、NO2等有毒气体,其污染问题也成为当今社会急需解决的问题.