题目内容
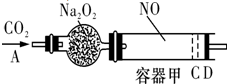 如图装置中,容器甲内充入1mol NO气体,干燥管内装有一定量Na2O2,从A处缓慢通入CO2气体.恒温下,容器甲中活塞缓慢由D向左移动,当移至C处时,容器体积缩小至最小,为原体积的
如图装置中,容器甲内充入1mol NO气体,干燥管内装有一定量Na2O2,从A处缓慢通入CO2气体.恒温下,容器甲中活塞缓慢由D向左移动,当移至C处时,容器体积缩小至最小,为原体积的| 9 |
| 10 |
已知当活塞移至C处时,干燥管中物质的质量增加了22.4g.
(1)当活塞移至C处时,通入标准状况下的CO2气体为
(2)当活塞移至C处时,容器甲中NO2转化为N2O4的转化率是多少(注意:本小题要求写出计算过程)?
(3)活塞移至C处后,继续通入a mol CO2,此时活塞恰好回至D处,则a值必
(4)若改变干燥管中Na2O2的量,要通过调节容器甲的温度及通入CO2的量,使活塞发生从D到C,又从C到D的移动.Na2O2的质量若为b g(b大于15.6g),该如何调节温度和通入CO2的量?
考点:化学平衡的影响因素,化学方程式的有关计算
专题:化学平衡专题
分析:(1)干燥管内质量增重,由于发生反应2Na2O2+2CO2=2Na2CO3+O2,利用差量法计算参加反应的二氧化碳的体积;
(2)容器甲中发生反应2NO+O2=2NO2,2NO2?N2O4,根据①计算生成氧气的体积,进而计算n(O2),根据过量计算,判断氧气与NO反应生成的二氧化氮的物质的量,此过程容器甲的体积不变,此后由于发生反应2NO2?N2O4,甲容器的体积减小,根据体积变化,判断混合气体物质的量减少量,根据差量法计算参加反应的二氧化氮的物质的量,再根据转化率定义计算;
(3)活塞移至C,体积不会再减少,则干燥管中Na2O2已反应完,活塞由C向D移动,体积扩大,2NO2?N2O4平衡左移,使二者物质的量增多,活塞移至D时,气体物质的量共增加0.01 mol,因此所需CO2必小于0.01 mol;
(4)实现从D→C的移动,只能通过降温使2NO2?N2O4的平衡向右移动(此反应为放热反应),实现从C→D,可以通入较多的CO2或升温.
(2)容器甲中发生反应2NO+O2=2NO2,2NO2?N2O4,根据①计算生成氧气的体积,进而计算n(O2),根据过量计算,判断氧气与NO反应生成的二氧化氮的物质的量,此过程容器甲的体积不变,此后由于发生反应2NO2?N2O4,甲容器的体积减小,根据体积变化,判断混合气体物质的量减少量,根据差量法计算参加反应的二氧化氮的物质的量,再根据转化率定义计算;
(3)活塞移至C,体积不会再减少,则干燥管中Na2O2已反应完,活塞由C向D移动,体积扩大,2NO2?N2O4平衡左移,使二者物质的量增多,活塞移至D时,气体物质的量共增加0.01 mol,因此所需CO2必小于0.01 mol;
(4)实现从D→C的移动,只能通过降温使2NO2?N2O4的平衡向右移动(此反应为放热反应),实现从C→D,可以通入较多的CO2或升温.
解答:
解:(1)设通入标准状况下CO2气体的体积为x,产生氧气的体积为y,则:
2Na2O2+2CO2=2Na2CO3+O2 质量装置△m
2×22.4 L 22.4 L 56 g
x y 22.4g
所以56 g:22.4g=2×22.4 L:x,解得x=17.92L,
56 g:22.4g=22.4 L:y,解得y=8.96L,
故答案为:17.92L;
(2)由①计算可知,生成氧气的物质的量n(O2)=
=0.4mol,
2NO+O2=2NO2
2 1 2
0.8mol 0.4 mol 0.8 mol
1 mol>0.8mol,所以NO过量,生成NO2的物质的量为0.8 mol.
所以2NO2?N2O4 物质的量减少△n
2 1 1
0.2 mol 1 mol×(1-
)=0.1mol
所以NO2转化为N2O4的转化率为
×100%=25%,
答:NO2转化为N2O4的转化率为25%.
(3)活塞移至C,体积不会再减少,则干燥管中Na2O2已反应完,活塞由C向D移动,体积扩大,2NO2?N2O4平衡左移,使二者物质的量增多,活塞移至D时,气体物质的量共增加0.01 mol,因此所需CO2必小于0.01 mol,
故答案为:小于;活塞移至C,体积不会再减少,则干燥管中Na2O2已反应完,活塞由C向D移动,体积扩大,2NO2?N2O4平衡左移,使二者物质的量增多,活塞移至D时,气体物质的量共增加0.01 mol,因此所需CO2必小于0.01 mol;
(4)反应2NO2?N2O4 △H<0,反应放热,实现从D→C的移动,只能通过降温使2NO2?N2O4的平衡向右移动,气体体积变小;实现从C→D,可以通入较多的CO2或升温,使产生的气体物质的量增多,
故答案为:实现从D→C的移动,只能通过降温使2NO2?N2O4的平衡向右移动,气体体积变小;实现从C→D,可以通入较多的CO2或升温,使产生的气体物质的量增多.
2Na2O2+2CO2=2Na2CO3+O2 质量装置△m
2×22.4 L 22.4 L 56 g
x y 22.4g
所以56 g:22.4g=2×22.4 L:x,解得x=17.92L,
56 g:22.4g=22.4 L:y,解得y=8.96L,
故答案为:17.92L;
(2)由①计算可知,生成氧气的物质的量n(O2)=
| 8.96L |
| 22.4L/mol |
2NO+O2=2NO2
2 1 2
0.8mol 0.4 mol 0.8 mol
1 mol>0.8mol,所以NO过量,生成NO2的物质的量为0.8 mol.
所以2NO2?N2O4 物质的量减少△n
2 1 1
0.2 mol 1 mol×(1-
| 9 |
| 10 |
所以NO2转化为N2O4的转化率为
| 0.2mol |
| 0.8mol |
答:NO2转化为N2O4的转化率为25%.
(3)活塞移至C,体积不会再减少,则干燥管中Na2O2已反应完,活塞由C向D移动,体积扩大,2NO2?N2O4平衡左移,使二者物质的量增多,活塞移至D时,气体物质的量共增加0.01 mol,因此所需CO2必小于0.01 mol,
故答案为:小于;活塞移至C,体积不会再减少,则干燥管中Na2O2已反应完,活塞由C向D移动,体积扩大,2NO2?N2O4平衡左移,使二者物质的量增多,活塞移至D时,气体物质的量共增加0.01 mol,因此所需CO2必小于0.01 mol;
(4)反应2NO2?N2O4 △H<0,反应放热,实现从D→C的移动,只能通过降温使2NO2?N2O4的平衡向右移动,气体体积变小;实现从C→D,可以通入较多的CO2或升温,使产生的气体物质的量增多,
故答案为:实现从D→C的移动,只能通过降温使2NO2?N2O4的平衡向右移动,气体体积变小;实现从C→D,可以通入较多的CO2或升温,使产生的气体物质的量增多.
点评:考查NO、CO2和过氧化钠反应的有关计算与判断,试题综合性强,过程复杂,计算量很大,难度很大,为易错题目,该题是高考中的常见考点和题型,旨在考查学生灵活运用基础知识解决实际问题的能力,有利于培养学生的逻辑推理能力和发散思维能力,侧重对学生能力的培养和解题方法的指导与训练.

练习册系列答案
 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案
相关题目
据报道,2003年12月26日,重庆开县发生了天然气矿井“井喷”事件,喷出的气体中要成分是甲烷,还含有硫化氢(H2S)、氰化氢(HCN)等多种有毒气体,造成290多人中毒死亡.你认为喷出的气体是( )
| A、一种纯净物 |
| B、全部由无机化合物组成的混合物 |
| C、全部由有机化合物组成的混合物 |
| D、由无机化合物和有机化合物组成的混合物 |
土壤胶体颗粒带负电荷,因此土壤中施用含氮总量相同的下列化肥时,肥效最差的是( )
| A、硫铵 | B、氯化铵 |
| C、碳铵 | D、硝酸铵 |
 在2L密闭容器内,800℃时反应2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如下表:
在2L密闭容器内,800℃时反应2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如下表: