题目内容
25℃时,0.1mol/L的HA溶液中c(H+)/c(OH-)=1010.请回答下列问题:
①HA是 (填“强电解质”或“弱电解质”).
②在加水稀释HA溶液的过程中,随着水量的增加而增大的是 (填字母).
A.c(H+)/c(HA) B.c(HA)/(A-)
C.c(H+)与c(OH-)的乘积 D.c(OH-)
①HA是
②在加水稀释HA溶液的过程中,随着水量的增加而增大的是
A.c(H+)/c(HA) B.c(HA)/(A-)
C.c(H+)与c(OH-)的乘积 D.c(OH-)
考点:弱电解质在水溶液中的电离平衡,强电解质和弱电解质的概念
专题:电离平衡与溶液的pH专题
分析:①25℃时,0.1mol/L的HA溶液中c(H+)/c(OH-)=1010,c(H+).c(OH-)=10-14,则溶液中c(H+)=0.01mol/L<0.1mol/L;
②HA是弱电解质,加水稀释促进HA电离,但HA电离增大程度小于溶液体积增大程度,所以c(H+)、c(HA)、c(A-)都减小,温度不变,水的离子积常数不变.
②HA是弱电解质,加水稀释促进HA电离,但HA电离增大程度小于溶液体积增大程度,所以c(H+)、c(HA)、c(A-)都减小,温度不变,水的离子积常数不变.
解答:
解:①25℃时,0.1mol/L的HA溶液中c(H+)/c(OH-)=1010,c(H+).c(OH-)=10-14,则溶液中c(H+)=0.01mol/L<0.1mol/L,说明HA在水溶液里部分电离,则为弱电解质,故答案为:弱电解质;
②HA是弱电解质,加水稀释促进HA电离,但HA电离增大程度小于溶液体积增大程度,所以c(H+)、c(HA)、c(A-)都减小,温度不变,水的离子积常数不变,
A.加水稀释促进HA电离,则n(H+)增大、n(HA)减小,溶液体积相同,所以c(H+)/c(HA)增大,故A正确;
B.加水稀释促进HA电离,则n(HA)减小、n(A-)增大,所以c(HA)/(A-)减小,故B错误;
C.温度不变,则c(H+)与c(OH-)的乘积不变,故C错误;
D.温度不变,则c(H+)与c(OH-)的乘积不变,加水稀释c(H+)减小,则c(OH-)增大,故D正确;
故选AD.
②HA是弱电解质,加水稀释促进HA电离,但HA电离增大程度小于溶液体积增大程度,所以c(H+)、c(HA)、c(A-)都减小,温度不变,水的离子积常数不变,
A.加水稀释促进HA电离,则n(H+)增大、n(HA)减小,溶液体积相同,所以c(H+)/c(HA)增大,故A正确;
B.加水稀释促进HA电离,则n(HA)减小、n(A-)增大,所以c(HA)/(A-)减小,故B错误;
C.温度不变,则c(H+)与c(OH-)的乘积不变,故C错误;
D.温度不变,则c(H+)与c(OH-)的乘积不变,加水稀释c(H+)减小,则c(OH-)增大,故D正确;
故选AD.
点评:本题考查电解质强弱判断、弱电解质电离,知道强弱电解质的本质区别,注意稀释弱电解质时并不是溶液中所有微粒浓度都减小,为易错点.

练习册系列答案
 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案
相关题目
某气体的水溶液呈酸性,该气体能使酸性高锰酸钾溶液褪色,也能使溴水褪色并出现浑浊,该气体是( )
| A、HBr |
| B、SO2 |
| C、H2S |
| D、CO2 |
在六种物质①氨水、②冰醋酸、③氢硫酸、④一水合氨、⑤硫酸钡、⑥氟化钠中,属于弱电解质的是( )
| A、都是 | B、除⑥外都是 |
| C、②③④ | D、②④ |
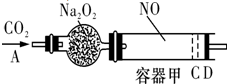 如图装置中,容器甲内充入1mol NO气体,干燥管内装有一定量Na2O2,从A处缓慢通入CO2气体.恒温下,容器甲中活塞缓慢由D向左移动,当移至C处时,容器体积缩小至最小,为原体积的
如图装置中,容器甲内充入1mol NO气体,干燥管内装有一定量Na2O2,从A处缓慢通入CO2气体.恒温下,容器甲中活塞缓慢由D向左移动,当移至C处时,容器体积缩小至最小,为原体积的
