题目内容
有 A,B,C、D四种短周期元素,它们的原子序数由A到D依次增大,已知A和B原子有相同的电子层数,且A的L层电子数是K层电子数的两倍,C燃烧时呈现黄色火焰,C的单质在点燃条件下与B的单质充分反应,可以得到与D单质颜色相同的淡黄色固态化合物,试根据以上叙述回答:
(1)元素名称:A B C D .
(2)写出C2B2的电子式为 .
(3)用电子式表示化合物C2D的形成过程 .
(4)在
H,
H,
H,
Mg,
Mg,
O,
O,
O中共有 种元素, 种原子,中子数最多的是 .D
O的相对分子质量是 .
(1)元素名称:A
(2)写出C2B2的电子式为
(3)用电子式表示化合物C2D的形成过程
(4)在
1 1 |
2 1 |
3 1 |
23 12 |
24 12 |
16 8 |
17 8 |
18 8 |
18 2 |
考点:位置结构性质的相互关系应用
专题:
分析:有A、B、C、D四种短周期元素,它们的原子序数由A到D依次增大.已知A和B原子有相同的电子层数,则A、B处于同一周期,且A的L层电子数是K层电子数的两倍,则A有2个电子层,L层电子数为4,故A为碳元素;C单质燃烧时呈现黄色火焰,则C为钠元素;C的单质在点燃时与足量的B单质充分反应,可以得到与D单质颜色相同的淡黄色固态化合物,则B为氧元素,D为硫元素,据此解答.
解答:
解:有A、B、C、D四种短周期元素,它们的原子序数由A到D依次增大.已知A和B原子有相同的电子层数,则A、B处于同一周期,且A的L层电子数是K层电子数的两倍,则A有2个电子层,L层电子数为4,故A为碳元素;C单质燃烧时呈现黄色火焰,则C为钠元素;C的单质在点燃时与足量的B单质充分反应,可以得到与D单质颜色相同的淡黄色固态化合物,则B为氧元素,D为硫元素,
(1)通过以上分析知,A是碳,B是氧,C是钠,D是硫,故答案为:碳;氧;钠;硫;
(2)Na2O2由钠离子与过氧根离子构成,其电子式为 ,故答案为:
,故答案为: ;
;
(3)C2D是硫化钠,由钠离子与硫离子构成,硫化钠电子式为 ,用电子式表示其形成过程为:
,用电子式表示其形成过程为: ,
,
故答案为: ;
;
(4)在11H,12H,13H,1223Mg,1224Mg,816O,817O,818O中有氧元素、氢元素和镁元素三种,这8种微粒均具有一定数目的质子数和一定数目的中子数,均属于原子,即有8种原子,中子数=质量数-中子数,可知中子数最多的是12个,为1224Mg,12H218O的相对分子质量=2×2+18=22,
故答案为:3;8;1224Mg;22.
(1)通过以上分析知,A是碳,B是氧,C是钠,D是硫,故答案为:碳;氧;钠;硫;
(2)Na2O2由钠离子与过氧根离子构成,其电子式为
 ,故答案为:
,故答案为: ;
;(3)C2D是硫化钠,由钠离子与硫离子构成,硫化钠电子式为
 ,用电子式表示其形成过程为:
,用电子式表示其形成过程为: ,
,故答案为:
 ;
;(4)在11H,12H,13H,1223Mg,1224Mg,816O,817O,818O中有氧元素、氢元素和镁元素三种,这8种微粒均具有一定数目的质子数和一定数目的中子数,均属于原子,即有8种原子,中子数=质量数-中子数,可知中子数最多的是12个,为1224Mg,12H218O的相对分子质量=2×2+18=22,
故答案为:3;8;1224Mg;22.
点评:本题考查结构性质位置关系应用,侧重对电子式的考查,注意掌握电子式表示化学键或物质的性质过程.

练习册系列答案
相关题目
 海水中含有丰富的锂资源,研究人员开发了一种只能让锂离子通过的特殊交换膜,并运用电解实现从海水中提取高浓度的锂盐,其工作原理如图所示.下列说法不正确的是( )
海水中含有丰富的锂资源,研究人员开发了一种只能让锂离子通过的特殊交换膜,并运用电解实现从海水中提取高浓度的锂盐,其工作原理如图所示.下列说法不正确的是( )| A、a 连接电源的正极 |
| B、Li+的移动方向是从海水进入到盐酸中 |
| C、过程中还可能获得有经济价值的副产物氢气和氯气 |
| D、一段时间后,b电极附近溶液的pH降低 |
五种短周期元素在周期表中的位置如图所示,其中Z元素原子的最外层电子数等于电子层数.下列判断正确的是
( )
| X | Y | ||
| Z | M | R |
| A、Z的氧化物可以做光导纤维 |
| B、气态氢化物稳定性:M>R |
| C、最高价氧化物对应水化物的酸性:Y>X |
| D、Z、M、R的原子半径依次增大,最高化合价依次升高 |
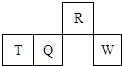 短周期元素R、T、Q、W在元素周期标准的相对位置如图所示,其中T所处的周期序数和族序数相等.下列判断不正确的是( )
短周期元素R、T、Q、W在元素周期标准的相对位置如图所示,其中T所处的周期序数和族序数相等.下列判断不正确的是( )| A、R的简单气态氢化物可以使湿润红色石蕊试纸变蓝 |
| B、W的最高价氧化物的水化物是一种强酸 |
| C、Q的最高价氧化物难溶于水 |
| D、T最高价氧化物的水化物是一种强碱 |
关于下列图示的说法中正确的是( )
A、 该图表示该实验可比较氯、碳、硅三种元素的非金属性强弱 该图表示该实验可比较氯、碳、硅三种元素的非金属性强弱 |
B、 该图所示实验装置排空气法收集CO2气体 该图所示实验装置排空气法收集CO2气体 |
C、 该图表示反应CO(g)+H2O(g)?CO2(g)+H2(g)是放热反应 该图表示反应CO(g)+H2O(g)?CO2(g)+H2(g)是放热反应 |
D、 该图表示两个装置中通过导线的电子数相同时,消耗负极材料的物质的量也相同 该图表示两个装置中通过导线的电子数相同时,消耗负极材料的物质的量也相同 |
 X、Y、Z、W、Q、R均为前四周期元素,且原子序数依次增大.其相关信息如下表所示:
X、Y、Z、W、Q、R均为前四周期元素,且原子序数依次增大.其相关信息如下表所示:
 如图所示的装置中,A、B均为石墨电极.回答下列问题:
如图所示的装置中,A、B均为石墨电极.回答下列问题: