题目内容
8.为探索月球上是否有生命痕迹,科学家用氘盐酸(DCl)和重水(D2O)溶液处理月球上某岩石样品,若电解这种氘盐酸,在阳极上放出1.12L气体(标准状况,下同),同时在另一极放出气体的量为( )| A. | 560mL | B. | 1120mL | C. | 0.1g | D. | 0.2g |
分析 用惰性电极电解氘盐酸时,阳极上氯离子放电生成氯气、阴极上氘离子放电生成氘气,所以相当于电解DCl,电解方程式为2DCl$\frac{\underline{\;电解\;}}{\;}$D2↑+Cl2↑,根据方程式知相同条件下生成氘气和氯气物质的量相等、体积相等,则n(D2)=n(Cl2)=$\frac{1.12L}{22.4L/mol}$=0.05mol,根据m=nM计算氘气质量.
解答 解:用惰性电极电解氘盐酸时,阳极上氯离子放电生成氯气、阴极上氘离子放电生成氘气,所以相当于电解DCl,电解方程式为2DCl$\frac{\underline{\;电解\;}}{\;}$D2↑+Cl2↑,根据方程式知相同条件下生成氘气和氯气物质的量相等、体积相等,所以阴极生成气体体积为1120mL,则n(D2)=n(Cl2)=$\frac{1.12L}{22.4L/mol}$=0.05mol,则m(D2)=nM=0.05mol×4g/mol=0.2g,故选BD.
点评 本题考查电解原理,为高频考点,明确各个电极上放电离子是解本题关键,注意氘气摩尔质量是4g/mol而不是2g/mol,为易错点.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
19. 硫及其化合物对人类的生产和生活有着重要的作用.
硫及其化合物对人类的生产和生活有着重要的作用.
2SO2(g)+O2(g)?2SO3(g)△H=-198kJ•mol-1是制备硫酸的重要反应.
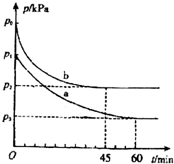
(1)在容积为V L的密闭容器中起始充入2mol SO2和1mol O2,反应在不同条件下进行,反应体系总压强随时间的变化如下图所示.与实验a相比,实验b改变的条件是升高温度,判断的依据实验b与a相比,反应速率快,平衡向逆反应方向移动.
(2)二氧化硫在一定条件下还可以发生如下反应:
SO2(g)+NO2(g)?SO3(g)+NO(g)△H=-42kJ•mol-1.
在1L恒容密闭容器中充入SO2(g)和NO2(g),所得实验数据如下:
①实验甲中,若2min时测得放出的热量是4.2kJ,则0~2min时间内,用SO2(g)表示的平均反应速率v(SO2)=0.05mol/(L.min),该温度下的平衡常数2.613.
②实验丙中,达到平衡时,NO2的转化率为$\frac{10a}{3}$×100%.
③由表中数据可推知,Tl<T2(填“>”“<’’或“=”),判断的理由是T1时,该反应的平衡常数K1=2.613,T2时,该反应的平衡常数K2=1,该反应正反应为放热反应,所以T1<T2.
 硫及其化合物对人类的生产和生活有着重要的作用.
硫及其化合物对人类的生产和生活有着重要的作用.2SO2(g)+O2(g)?2SO3(g)△H=-198kJ•mol-1是制备硫酸的重要反应.
(1)在容积为V L的密闭容器中起始充入2mol SO2和1mol O2,反应在不同条件下进行,反应体系总压强随时间的变化如下图所示.与实验a相比,实验b改变的条件是升高温度,判断的依据实验b与a相比,反应速率快,平衡向逆反应方向移动.
(2)二氧化硫在一定条件下还可以发生如下反应:
SO2(g)+NO2(g)?SO3(g)+NO(g)△H=-42kJ•mol-1.
在1L恒容密闭容器中充入SO2(g)和NO2(g),所得实验数据如下:
| 实验编号 | 温度 | 起始时物质的量/mol | 平衡时物质的量/mol | |
| N(SO2) | N(NO2) | N(NO) | ||
| 甲 | T1 | 0.80 | 0.20 | 0.18 |
| 乙 | T2 | 0.20 | 0.80 | 0.16 |
| 丙 | T3 | 0.20 | 0.30 | a |
②实验丙中,达到平衡时,NO2的转化率为$\frac{10a}{3}$×100%.
③由表中数据可推知,Tl<T2(填“>”“<’’或“=”),判断的理由是T1时,该反应的平衡常数K1=2.613,T2时,该反应的平衡常数K2=1,该反应正反应为放热反应,所以T1<T2.
3.W、X、Y、Z均为短周期主族元素,原子序数依次增加,且原子核外L电子层的电子数分别为0、5、8、8,它们的最外层电子数之和为18.下列说法正确的是( )
| A. | 阴离子的半径:Z>Y | |
| B. | 气态氢化物稳定性:Z>Y>X | |
| C. | 氧化物的水化物的酸性:Z>Y | |
| D. | 元素W、X、Z各自最高和最低化合价的代数和分别为0、2、6 |
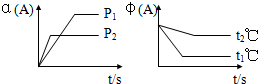
20.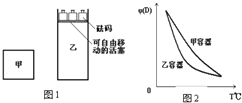 一定温度下,有可逆反应:2A(g)+2B(g)?C(g)+3D(g);△H<0.现将2molA和2mol B充入体积为V的甲容器,将2 mol C和6 mol D充入乙容器并使乙容器在反应开始前的体积为2V(如图1).关于两容器中反应的说法正确的是( )
一定温度下,有可逆反应:2A(g)+2B(g)?C(g)+3D(g);△H<0.现将2molA和2mol B充入体积为V的甲容器,将2 mol C和6 mol D充入乙容器并使乙容器在反应开始前的体积为2V(如图1).关于两容器中反应的说法正确的是( )
 一定温度下,有可逆反应:2A(g)+2B(g)?C(g)+3D(g);△H<0.现将2molA和2mol B充入体积为V的甲容器,将2 mol C和6 mol D充入乙容器并使乙容器在反应开始前的体积为2V(如图1).关于两容器中反应的说法正确的是( )
一定温度下,有可逆反应:2A(g)+2B(g)?C(g)+3D(g);△H<0.现将2molA和2mol B充入体积为V的甲容器,将2 mol C和6 mol D充入乙容器并使乙容器在反应开始前的体积为2V(如图1).关于两容器中反应的说法正确的是( )| A. | 甲容器中的反应先达到化学平衡状态 | |
| B. | 两容器中的反应均达平衡时,平衡混合物中各组份的体积百分组成相同,混合气体的平均相对分子质量也相同 | |
| C. | 两容器达平衡后升高相同的温度,两容器中物质D的体积分数随温度变化如图2所示 | |
| D. | 在甲容器中再充入2 mol A和2 mol B,平衡后甲中物质C的浓度和乙中物质C的浓度相同 |
17.下列有关的叙述正确的是( )
| A. | 磷在氯气中燃烧产生大量的白烟,并放出热量 | |
| B. | 纯净的氢气在氯气中安静燃烧,发出黄色火焰 | |
| C. | 光照新制氯水有气泡逸出,该气体是Cl2 | |
| D. | 实验室制备氯气可用排饱和食盐水法收集 |
18.25℃时,在等体积的①pH=0的H2SO4溶液,②0.05mol•L-1的Ba(OH)2溶液中,发生电离的水的物质的量之比是( )
| A. | 1:10 | B. | 1:5 | C. | 1:20 | D. | 1:10 |