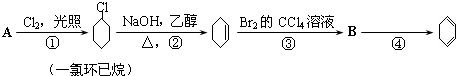
题目内容
电极电解某金属的氯化物(MCl2)溶液,当阳极上收集到1.12L Cl2时(标准状况),阴极增重3.2g.下列有关叙述正确的是( )
| A、M的相对原子质量为32 |
| B、电解过程中溶液的pH不发生变化 |
| C、M的相对原子质量为64 |
| D、电路中通过0.5mol电子 |
考点:电解原理
专题:
分析:n(Cl2)=
=0.05mol,则n(M2+)=0.05mol,根据M=
计算相对原子质量,根据2Cl--2e-=Cl2计算转移电子数,根据电解总反应式判断pH变化.
| 1.12L |
| 22.4L/mol |
| m |
| n |
解答:
解:n(Cl2)=
=0.05mol,则n(M2+)=0.05mol,M=
=
=64g/mol,则相对原子质量为64,为铜元素,故A错误,C正确;
根据2Cl--2e-=Cl2可知,电路中转移的电子的物质的量为2×n(Cl2)=2×0.05mol=0.1mol,故D错误;
电解总反应式为:MCl2
M+Cl2↑,为电解电解质形,MCl2为氯化铜,铜离子水解显酸性,电解完显中性,pH发生了变化,故B错误;
故选C.
| 1.12L |
| 22.4L/mol |
| m |
| n |
| 3.2g |
| 0.05mol |
根据2Cl--2e-=Cl2可知,电路中转移的电子的物质的量为2×n(Cl2)=2×0.05mol=0.1mol,故D错误;
电解总反应式为:MCl2
| ||
故选C.
点评:本题考查电解原理,侧重于电解的计算,只根据物质的组成和电极反应式进行相关的计算.

练习册系列答案
相关题目
下列推断正确的是( )
| A、金属单质与盐溶液的反应都是置换反应 |
| B、SO2和CO2都是酸性氧化物,都能与NaOH溶液反应 |
| C、Na2O和Na2O2组成元素相同,与CO2反应产物也完全相同 |
| D、C、N、S三种单质直接与O2反应都能生成两种以上氧化物 |
常温下,下列电解质溶液的有关叙述正确的是( )
| A、新制氯水中加入固体NaOH:c(Na+)=c(Cl-)+c(ClO-)+c(OH-) |
| B、pH=8.3的NaHCO3溶液:c(Na+)>c(HCO3-)>c(H2CO3)>c(CO32-) |
| C、pH═11的氨水与pH=3的盐酸等体积混合:c(Cl-)=c(NH4+)>c(OH-)=c(H+) |
| D、同浓度同体积的强酸与强碱溶液混合后,溶液的pH=7 |
下列实验过程中产生的现象与对应的图形正确的是( )
A、 氨气通入硫酸溶液中 |
B、 NaOH溶液中逐滴加入AlCl3溶液至过量 |
C、 向1L1.0mol?L-1的明矾溶液中加入Ba(OH)2溶液 |
D、 pH=2的盐酸和醋酸分别加水稀释 |
25℃时,向含有AgCl(s)的饱和AgCl溶液中加水,下列叙述正确的是( )
| A、AgCl的溶解度增大 |
| B、AgCl的溶解度、Ksp均不变 |
| C、Ksp(AgCl)增大 |
| D、AgCl的溶解度、Ksp均增大 |
下列说法中不正确的是( )
| A、离子晶体中不一定含有金属元素 |
| B、晶格能越大,物质的硬度反而越小 |
| C、在含有阳离子的化合物晶体中,一定含有阴离子 |
| D、原子晶体的熔点不一定比金属晶体的高 |
 (1)甲醇是一种优质燃料,可制作燃料电池,工业上可用下列两种反应制备甲醇:
(1)甲醇是一种优质燃料,可制作燃料电池,工业上可用下列两种反应制备甲醇: