题目内容
已知2H2(g)+O2(g)=2H2O(g)△H=-484kJ/mol.且氧气中1mol O=O键完全断裂时吸收热量496kJ,水蒸气中1mol H-O键形成时放出热量463kJ,则氢气中1mol H-H键断裂时吸收热量为( )
| A、920 kJ |
| B、557 kJ |
| C、436 kJ |
| D、188 kJ |
考点:有关反应热的计算
专题:化学反应中的能量变化
分析:化学反应放出的热量=新键生成释放的能量-旧键断裂吸收的能量.
解答:
解:氢气完全燃烧生成水蒸气是放热反应,2H2(g)+O2(g)═2H2O(g)△H=-484kJ/mol,则2mol氢气完全燃烧生成水蒸气时放出热量484kJ,
化学反应放出的热量=新键生成释放的能量-旧键断裂吸收的能量,设氢气中1molH-H键断裂时吸收热量为X,根据方程式:2H2+O2
2H2O,则:4×121kJ=463kJ×4-(2X+496kJ),解得X=436kJ.
故选C.
化学反应放出的热量=新键生成释放的能量-旧键断裂吸收的能量,设氢气中1molH-H键断裂时吸收热量为X,根据方程式:2H2+O2
| ||
故选C.
点评:本题考查学生化学反应中的能量变化知识,注意理解反应热与键能的关系,难度不大.

练习册系列答案
相关题目
NA为阿佛加德罗常数,下列叙述不正确的是( )
| A、标准状况下,22.4 L的CCl4中所含质子数为74 NA |
| B、2 mol SO2和1 mol O2在一定条件下充分反应后,所得混合气体的分子数大于2NA |
| C、12 g石墨晶体中含有的碳碳键数目为1.5 NA |
| D、分子数为0.1NA的N2和NH3混合气体,原子间含有的共用电子对数目为0.3NA |
已知醋酸、醋酸根离子在溶液中存在下列平衡及其对应的平衡常数
CH3COOH?CH3COO-+H+ K1=1.75×10-5△H1>0
CH3COO-+H2O?CH3COOH+OH- K2=5.71×10-10△H2>0
常温下,将等体积、等物质的量浓度的醋酸和醋酸钠溶液混合,则下列叙述正确的是( )
CH3COOH?CH3COO-+H+ K1=1.75×10-5△H1>0
CH3COO-+H2O?CH3COOH+OH- K2=5.71×10-10△H2>0
常温下,将等体积、等物质的量浓度的醋酸和醋酸钠溶液混合,则下列叙述正确的是( )
| A、对混合溶液进行微热,K1增大、K2减小 |
| B、混合溶液的pH>7 |
| C、混合溶液中c(CH3COO-)>c(Na+) |
| D、温度不变,若在混合溶液中加入少量NaOH固体,则c(CH3COO-)减小 |
常温下,一定浓度的某溶液由水电离出的c(OH-)=10-4 mol/L,则该溶液的溶质可能是( )
| A、AlCl3 |
| B、NaOH |
| C、Na2CO3 |
| D、NaHSO4 |
下列属于电解质的是( )
| A、NaCl溶液 |
| B、蔗糖 |
| C、CuSO4?5H2O |
| D、CO2 |
下列选项中发生了化学变化的是( )
| A、木料制家具 | B、大米酿酒 |
| C、石蜡熔化 | D、水制冰块 |

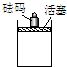 在一定条件下,向如图容器中加入一定量的A和B,发生反应:mA+nB?pC达到平衡.
在一定条件下,向如图容器中加入一定量的A和B,发生反应:mA+nB?pC达到平衡.