题目内容
某中药主要含二硫化亚铁(FeS2),某学习小组欲用如图1所示装置进行实验,测定其铁、硫元素的质量分数.

(1)装置中,A为高温灼烧装置,B为气体吸收装置,C为检测尾气中是否含有SO2的传感器.取m g该中药样品于装置A中,经充分反应,使硫元素全部转化为SO2和SO3,在B中得到白色沉淀,传感器(装置C)未检测到SO2.
①装置B中的H2O2反应时表现出了 性.
②欲计算硫元素的质量分数,需测量的数据是 .
③传感器的工作原理如图所2示.传感器中阴极的电极反应式是 .
(2)为测定铁元素的质量分数,继续实验.
a.将A装置中的剩余固体用足量盐酸酸浸,有少量H2产生.充分反应后过滤,得到黄色滤液;
b.向滤液中滴加TiCl3溶液,至恰好完全反应,TiCl3被氧化为TiO2+;
c.用滴定法测定Fe2+的量,消耗v mL n mol/LK2Cr2O7溶液.
①a中滤液含有的金属阳离子是 .
②b中反应的离子方程式是 .
③c中K2Cr2O7被还原为Cr3+,样品中铁元素质量分数的数学表示式是 .

(1)装置中,A为高温灼烧装置,B为气体吸收装置,C为检测尾气中是否含有SO2的传感器.取m g该中药样品于装置A中,经充分反应,使硫元素全部转化为SO2和SO3,在B中得到白色沉淀,传感器(装置C)未检测到SO2.
①装置B中的H2O2反应时表现出了
②欲计算硫元素的质量分数,需测量的数据是
③传感器的工作原理如图所2示.传感器中阴极的电极反应式是
(2)为测定铁元素的质量分数,继续实验.
a.将A装置中的剩余固体用足量盐酸酸浸,有少量H2产生.充分反应后过滤,得到黄色滤液;
b.向滤液中滴加TiCl3溶液,至恰好完全反应,TiCl3被氧化为TiO2+;
c.用滴定法测定Fe2+的量,消耗v mL n mol/LK2Cr2O7溶液.
①a中滤液含有的金属阳离子是
②b中反应的离子方程式是
③c中K2Cr2O7被还原为Cr3+,样品中铁元素质量分数的数学表示式是
考点:探究物质的组成或测量物质的含量
专题:实验探究和数据处理题
分析:(1)①取m g该中药样品于装置A中,经充分反应,FeS2燃烧生成二氧化硫和氧化铁,二氧化硫通入酸化的过氧化氢和氯化钡溶液中,使硫元素全部转化为SO2和SO3,在B中得到白色沉淀,发生氧化还原反应生成硫酸钡沉淀;
②元素守恒分析,需要测定B中沉淀质量计算硫元素物质的量;
③阴极发生还原反应,酸溶液中亚硫酸氢根离子得到电子生成S2O42-;
(2)①将A装置中的剩余固体用足量盐酸酸浸,有少量H2产生.充分反应后过滤,得到黄色滤液,说明含有铁和氧化铁;
②向滤液中滴加TiCl3溶液,至恰好完全反应,TiCl3被铁离子氧化为TiO2+;
③用滴定法测定Fe2+的量,消耗v mL n mol/LK2Cr2O7溶液,依据化学反应的定量关系计算得到.
②元素守恒分析,需要测定B中沉淀质量计算硫元素物质的量;
③阴极发生还原反应,酸溶液中亚硫酸氢根离子得到电子生成S2O42-;
(2)①将A装置中的剩余固体用足量盐酸酸浸,有少量H2产生.充分反应后过滤,得到黄色滤液,说明含有铁和氧化铁;
②向滤液中滴加TiCl3溶液,至恰好完全反应,TiCl3被铁离子氧化为TiO2+;
③用滴定法测定Fe2+的量,消耗v mL n mol/LK2Cr2O7溶液,依据化学反应的定量关系计算得到.
解答:
解:(1)①取m g该中药样品于装置A中,经充分反应,FeS2燃烧生成二氧化硫和氧化铁,二氧化硫通入酸化的过氧化氢和氯化钡溶液中,使硫元素全部转化为SO2和SO3,在B中得到白色沉淀,发生氧化还原反应生成硫酸钡沉淀;过氧化氢的主要作用是氧化剂氧化+4价硫为+6价硫酸根离子,装置B中的H2O2反应时表现出了氧化性;
故答案为:氧化;
②欲计算硫元素的质量分数,需要测定B中沉淀质量计算硫元素物质的量,所以测量的数据是B中沉淀的质量,故答案为:B中沉淀的质量;
③阴极发生还原反应,酸溶液中亚硫酸氢根离子得到电子生成S2O42-,电极反应为2HSO3-+2H++2e-=S2O42-+2H2O,故答案为:2HSO3-+2H++2e-=S2O42-+2H2O;
(2)①将A装置中的剩余固体用足量盐酸酸浸,有少量H2产生证明含有铁,充分反应后过滤,得到黄色滤液,说明含有氧化铁,所以盐酸溶解后得到溶液中含有阳离子为:Fe3+、Fe2+;
故答案为:Fe3+、Fe2+;
②向滤液中滴加TiCl3溶液,至恰好完全反应,TiCl3被铁离子氧化为TiO2+,反应的离子方程式为:Fe3++Ti3++H2O=Fe2++TiO2++2H+;
故答案为:Fe3++Ti3++H2O=Fe2++TiO2++2H+;
③用滴定法测定Fe2+的量,消耗v mL n mol/LK2Cr2O7溶液,则
6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O
6 1
n(Fe2+) v×10-3L×n mol/L
n=6vn×10-3mol
样品中铁元素质量分数=
×100%=
Vn×100%=
%,
故答案为:
%.
故答案为:氧化;
②欲计算硫元素的质量分数,需要测定B中沉淀质量计算硫元素物质的量,所以测量的数据是B中沉淀的质量,故答案为:B中沉淀的质量;
③阴极发生还原反应,酸溶液中亚硫酸氢根离子得到电子生成S2O42-,电极反应为2HSO3-+2H++2e-=S2O42-+2H2O,故答案为:2HSO3-+2H++2e-=S2O42-+2H2O;
(2)①将A装置中的剩余固体用足量盐酸酸浸,有少量H2产生证明含有铁,充分反应后过滤,得到黄色滤液,说明含有氧化铁,所以盐酸溶解后得到溶液中含有阳离子为:Fe3+、Fe2+;
故答案为:Fe3+、Fe2+;
②向滤液中滴加TiCl3溶液,至恰好完全反应,TiCl3被铁离子氧化为TiO2+,反应的离子方程式为:Fe3++Ti3++H2O=Fe2++TiO2++2H+;
故答案为:Fe3++Ti3++H2O=Fe2++TiO2++2H+;
③用滴定法测定Fe2+的量,消耗v mL n mol/LK2Cr2O7溶液,则
6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O
6 1
n(Fe2+) v×10-3L×n mol/L
n=6vn×10-3mol
样品中铁元素质量分数=
| 6vn×10-3mol×56g/mol |
| mg |
| 0.336 |
| m |
| 33.6vn |
| m |
故答案为:
| 33.6vn |
| m |
点评:本题考查了物质组成的分析判断,主要是实验工厂分析,反应实质的理解应用,物质性质和反应定量计算的应用,掌握基础是关键,题目难度中等.

练习册系列答案
相关题目
 T°C时,在一固定容积的密闭容器中发生反应:A(g)+B(g)?C(s)△H<0,按照不同配比充入A、B,达到平衡时容器中A、B浓度变化如图中曲线(实线)所示,下列判断正确的是( )
T°C时,在一固定容积的密闭容器中发生反应:A(g)+B(g)?C(s)△H<0,按照不同配比充入A、B,达到平衡时容器中A、B浓度变化如图中曲线(实线)所示,下列判断正确的是( )| A、T°C时,该反应的平衡常数值为4 |
| B、c点没有达到平衡,此时反应向逆向进行 |
| C、若c点为平衡点,则此时容器内的温度高于T°C |
| D、T°C时,直线cd上的点均为平衡状态 |
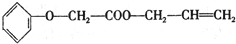 )的制备方法,据此回答问题:
)的制备方法,据此回答问题:
 (R-、R′-代表烃基)
(R-、R′-代表烃基) 的芳香族化合物有多种同分异构体,其中属于酯类,能使FeCl3溶液显紫色且苯环上的一氯代物只有两种的同分异构体的结构简式为
的芳香族化合物有多种同分异构体,其中属于酯类,能使FeCl3溶液显紫色且苯环上的一氯代物只有两种的同分异构体的结构简式为
 如图中每一个方框表示有关的一种反应物或生成物(部分生成物已省略),X是一种酸式盐,常用作化肥,加热分解生成A、B、C三种物质.其中A、C为无色气体,A能使澄清石灰水变浑浊,B在常温下是一种无色的液体.请填写下列空白:
如图中每一个方框表示有关的一种反应物或生成物(部分生成物已省略),X是一种酸式盐,常用作化肥,加热分解生成A、B、C三种物质.其中A、C为无色气体,A能使澄清石灰水变浑浊,B在常温下是一种无色的液体.请填写下列空白: