题目内容
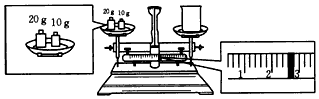
1.观察下列几个装置示意图,有关叙述正确的是( )
| A. | 装置②的待镀铁制品应与电源正极相连 | |
| B. | 装置①中阴极上析出红色固体 | |
| C. | 装置③闭合开关后,外电路电子由a极流向b极 | |
| D. | 装置④的X电极是外接电源的正极 |
分析 A、根据在电镀池中,镀件金属应该做阴极,镀层金属做阳极判断;
B、电解池的阳极是电解质中的阴离子失电子的过程;
C、在燃料电池中,电子从负极流向正极;
D、和电源正极相连的电极是阳极,阳极金属易被氧化.
解答 解:A、在电镀池中,镀件金属应该做阴极,应与电源负极相连,故A错误;
B、装置①中阴极上是电解质中的铜离子得电子生成铜的过程,所以析出红色固体,故B正确;
C、装置③闭合电键后,形成燃料电池,通氢气的极是负极,同氧气的极是正极,电子从负极流向正极,即由a极流向b极,故C正确;
D、装置④中,和电源正极X相连的电极铁是阳极,阳极铁易被氧化而腐蚀,达不到防腐蚀的目的,故D错误.
故选BC.
点评 本题考查学生原电池和电解池的工作原理知识,注意平时知识的积累是解题的关键,难度中等.

练习册系列答案
相关题目
11.节能减排是中国转型发展的必经之路,工业生产中联合生产是实现节能减排的重要措施,如图是几种工业生产的联合生产工艺:
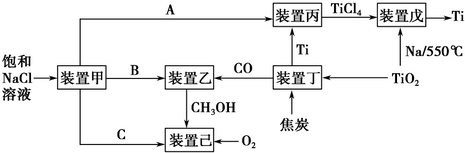
请回答下列问题:
(1)装置甲为电解池(惰性电极),根据图示转化关系可知:A为Cl2(填化学式),阴极反应式为2H++2e-=H2 ↑.
(2)装置丙的反应物为Ti,而装置戊的生成物为Ti,这两个装置在该联合生产中并不矛盾,原因是进入装置丙的Ti含有的杂质较多,从装置戊中出来的Ti较为纯净装置戊进行反应时需要的环境为C(填字母序号).
A.HCl气体氛围中 B.空气氛围中 C.氩气氛围中 D.水中
(3)装置乙中发生的是工业合成甲醇的反应:CO(g)+2H2(g)=CH3OH(g)△H<0.
①该反应在不同温度下的化学平衡常数(K)如下表:
符合表中的平衡常数x的数值是B(填字母序号).
A.0 B.0.012 C.32.081 D.100
②若装置乙为容积固定的密闭容器,不同时间段各物质的浓度如下表:
反应从2min到4min之间,H2的平均反应速率为0.3mol•L-1•min-1,反应达到平衡时CO的转化率为62.5%,反应在第2min时改变了反应条件,改变的条件可能是A(填字母序号).
A.使用催化剂 B.降低温度 C.增加H2的浓度.

请回答下列问题:
(1)装置甲为电解池(惰性电极),根据图示转化关系可知:A为Cl2(填化学式),阴极反应式为2H++2e-=H2 ↑.
(2)装置丙的反应物为Ti,而装置戊的生成物为Ti,这两个装置在该联合生产中并不矛盾,原因是进入装置丙的Ti含有的杂质较多,从装置戊中出来的Ti较为纯净装置戊进行反应时需要的环境为C(填字母序号).
A.HCl气体氛围中 B.空气氛围中 C.氩气氛围中 D.水中
(3)装置乙中发生的是工业合成甲醇的反应:CO(g)+2H2(g)=CH3OH(g)△H<0.
①该反应在不同温度下的化学平衡常数(K)如下表:
| 温度/℃ | 250 | 350 |
| K | 2.041 | x |
A.0 B.0.012 C.32.081 D.100
②若装置乙为容积固定的密闭容器,不同时间段各物质的浓度如下表:
| c(CO)/mol•L-1 | c(H2)/mol•L-1 | c(CH3OH)/mol•L-1 | |
| 0min | 0.8mol•L-1 | 1.6mol•L-1 | 0 |
| 2min | 0.6mol•L-1 | y | 0.2mol•L-1 |
| 4min | 0.3mol•L-1 | 0.6mol•L-1 | 0.5mol•L-1 |
| 6min | 0.3mol•L-1 | 0.6mol•L-1 | 0.5mol•L-1 |
A.使用催化剂 B.降低温度 C.增加H2的浓度.
12.医药中间体化合物X的结构简式如图所示.下列有关化合物X的说法正确的是( )
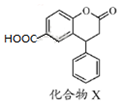

| A. | X的分子式为C16H11O4 | |
| B. | X分子中有三种不同的官能团 | |
| C. | 1 mol化合物X最多能与3 mol NaOH反应 | |
| D. | X分子中两个苯环一定处于同一平面 |
9.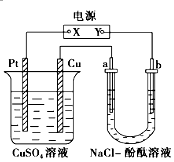 如图所示装置中,a、b都是惰性电极,通电一段时间后,b极附近溶液呈红色.下列说法正确的是( )
如图所示装置中,a、b都是惰性电极,通电一段时间后,b极附近溶液呈红色.下列说法正确的是( )
①X是正极,Y是负极 ②a是阴极,b是阳极
③CuSO4溶液的pH值逐渐减小 ④NaCl溶液的pH减小.
 如图所示装置中,a、b都是惰性电极,通电一段时间后,b极附近溶液呈红色.下列说法正确的是( )
如图所示装置中,a、b都是惰性电极,通电一段时间后,b极附近溶液呈红色.下列说法正确的是( )①X是正极,Y是负极 ②a是阴极,b是阳极
③CuSO4溶液的pH值逐渐减小 ④NaCl溶液的pH减小.
| A. | ①③ | B. | ②③ | C. | ①④ | D. | ②④ |
13.下列根据实验操作和现象所得出的结论正确的是( )
| 选项 | 实验操作 | 实验现象 | 结 论 |
| A | 用铂丝蘸取溶液进行焰色反应 | 火焰呈黄色 | 溶液中无K+ |
| B | 向溶液中先滴加稀盐酸,再滴加BaCl2溶液 | 先滴加稀盐酸无现象,滴加BaCl2后出现白色沉淀 | 溶液中一定含有SO42- |
| C | 向一定浓度的CuSO4溶液中通入适量H2S气体 | 出现黑色沉淀 | H2S的酸性比H2SO4强 |
| D | 向某溶液中滴加稀NaOH溶液,将湿润红色石蕊试纸置于试管口 | 试纸不变蓝 | 原溶液中无NH4+ |
| A. | A | B. | B | C. | C | D. | D |
10.一种新型熔融盐燃料电池具有高发电效率.现用Li2CO3和Na2CO3的熔融盐混合物作电解质,一极通CO气体,另一极通O2和CO2混合气体,其总反应为:2CO+O2═2CO2.则下列说法中正确的是( )
| A. | CO32-向正极移动 | |
| B. | 负极发生的电极反应是:O2+2CO2+4e-═2CO32- | |
| C. | 负极发生的电极反应是:CO+CO32--2e-═2CO2 | |
| D. | 正极发生氧化反应 |
11.常温下,向1L0.1mol•L-1CH3COONa溶液中,不断通入HCl气体.CH3COO-与CH3COOH 的变化趋势如图所示(假设HCl完全吸收且不考虑CH3COOH挥发及溶液体积变化),下列说法不正确的是( )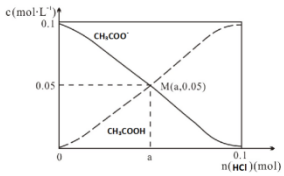

| A. | M点溶液中水的电离程度比原溶液小 | |
| B. | 在M点时,n(H+)-n(OH-)=(0.05-a )mol | |
| C. | 随着HCl的加入,$\frac{c(O{H}^{-})}{c(C{H}_{3}COO{H}^{-})}$不断减小 | |
| D. | 当n(HCl)=0.1mol时,c(Cl-)>c(CH3COOH)>c(H+) |