题目内容
室温下,取O.2mol/L H2A溶液与xmol/L NaOH溶液等体积混合(忽略混合后溶液体积变化),测得混合溶液的pH=y,下列推断不正确的是( )
| A、当x=0.2,则混合溶液中y可能大于7或小于7 |
| B、当x=0.2,y=1,则混合溶液中:c(H+)=c(A2-)+c(OH-) |
| C、当x=0.3,y>7,则混合溶液中:c(Na+)>c(A2-)>c(HA-)>c(OH-)>c(H+) |
| D、当x=0.4,则混合溶液中:[c(Na+)+c(H+)]>2c(A2-) |
考点:酸碱混合时的定性判断及有关ph的计算
专题:电离平衡与溶液的pH专题
分析:A、从H2A可能为强酸或弱酸两种角度来分析;
B、当x=0.2时,两者反应生成0.1mol/LNaHA溶液,由于y=1,故H2A为强酸,NaHA全部电离为Na+、H+和A2-;
C、当X=3时,反应后得浓度均为0.05mol/L的Na2A和NaHA的混合溶液,溶液显碱性,故A2-的水解程度大于HA-的电离程度,据此分析;
D、当x=0.4时,两者恰好完全反应生成0.1mol/LNa2A溶液,根据电荷守恒来分析.
B、当x=0.2时,两者反应生成0.1mol/LNaHA溶液,由于y=1,故H2A为强酸,NaHA全部电离为Na+、H+和A2-;
C、当X=3时,反应后得浓度均为0.05mol/L的Na2A和NaHA的混合溶液,溶液显碱性,故A2-的水解程度大于HA-的电离程度,据此分析;
D、当x=0.4时,两者恰好完全反应生成0.1mol/LNa2A溶液,根据电荷守恒来分析.
解答:
解:A、若X=0.2,酸过量,如果H2A为强酸,则溶液一定显酸性,即pH<7;如果H2A为弱酸,生成的NaHA中的HA-既能电离又能水解,如果HA-的电离程度大于其水解程度,溶液显酸性,pH<7;如果HA-的电离程度等于其水解程度,溶液显中性,pH=7;如果HA-的电离程度小于其水解程度,溶液显碱性,pH>7;故混合溶液中y可能大于7或小于7,故A正确;
B、当x=0.2时,两者反应生成0.1mol/LNaHA溶液,由于混合溶液的y=1,说明NaHA全部电离为Na+、H+和A2-,即H2A为强酸,A2-是强酸根,不水解,则0.1mol/LNaHA溶液中,C(Na+)=0.1mol/L,C(A2-)=0.1mol/L,根据溶液的电荷守恒有:C(Na+)+C(H+)=2C(A2-)+C(OH-),故有c(H+)=c(A2-)+c(OH-),故B正确;
C、当X=3时,反应后得浓度均为0.05mol/L的Na2A和NaHA的混合溶液,溶液显碱性,说明A2-的水解程度大于HA-的电离程度:A2-+H2O?HA-+OH-,HA-?A2-+H+,故c(A2-)<0.05mol/L,c(HA-)>0.05mol/L,故应有:c(HA-)>c(A2-),故C错误;
D、当x=0.4时,两者恰好完全反应生成0.1mol/LNa2A溶液,如果H2A为强酸,则Na2A为强酸强碱盐,则溶液中电荷守恒为:c(Na+)+c(H+)=2c(A2-)+c(OH-),故有:[c(Na+)+c(H+)]>2c(A2-);如果H2A为弱酸,则Na2A为弱酸强碱盐,则溶液中电荷守恒为:c(Na+)+c(H+)=2c(A2-)+c(OH-)+c(HA-),故有:[c(Na+)+c(H+)]>2c(A2-);故D正确.
故选C.
B、当x=0.2时,两者反应生成0.1mol/LNaHA溶液,由于混合溶液的y=1,说明NaHA全部电离为Na+、H+和A2-,即H2A为强酸,A2-是强酸根,不水解,则0.1mol/LNaHA溶液中,C(Na+)=0.1mol/L,C(A2-)=0.1mol/L,根据溶液的电荷守恒有:C(Na+)+C(H+)=2C(A2-)+C(OH-),故有c(H+)=c(A2-)+c(OH-),故B正确;
C、当X=3时,反应后得浓度均为0.05mol/L的Na2A和NaHA的混合溶液,溶液显碱性,说明A2-的水解程度大于HA-的电离程度:A2-+H2O?HA-+OH-,HA-?A2-+H+,故c(A2-)<0.05mol/L,c(HA-)>0.05mol/L,故应有:c(HA-)>c(A2-),故C错误;
D、当x=0.4时,两者恰好完全反应生成0.1mol/LNa2A溶液,如果H2A为强酸,则Na2A为强酸强碱盐,则溶液中电荷守恒为:c(Na+)+c(H+)=2c(A2-)+c(OH-),故有:[c(Na+)+c(H+)]>2c(A2-);如果H2A为弱酸,则Na2A为弱酸强碱盐,则溶液中电荷守恒为:c(Na+)+c(H+)=2c(A2-)+c(OH-)+c(HA-),故有:[c(Na+)+c(H+)]>2c(A2-);故D正确.
故选C.
点评:本题考查了酸碱混合后溶液中离子浓度的大小比较和溶液酸碱性的判断,根据H2A的强弱来讨论是解题关键,难度不大.

练习册系列答案
相关题目
下列实验操作或有关叙述正确的是( )
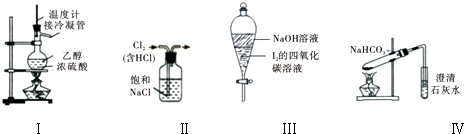

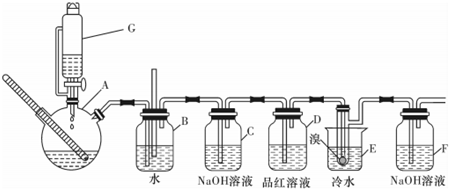
| A、用装置Ⅰ在实验室制备少量乙烯 |
| B、用装置Ⅱ来除去氯气中含有的HCl气体 |
| C、装置Ⅲ中,充分振荡后静置,下层溶液颜色保持不变 |
| D、用装置Ⅳ来探究NaHCO3的热稳定性 |
已知如下两个热化学反应方程式:下列说法错误的是( )
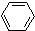 (1)+H2(g)→
(1)+H2(g)→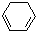 (1)-Q ①
(1)-Q ①
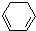 (1)+2H2(g)→
(1)+2H2(g)→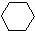 (1)+Q ②
(1)+Q ②
 (1)+H2(g)→
(1)+H2(g)→ (1)-Q ①
(1)-Q ① (1)+2H2(g)→
(1)+2H2(g)→ (1)+Q ②
(1)+Q ②| A、反应①、②都属于加成反应 |
| B、1,3-环己二烯比苯稳定 |
| C、反应①、②的热效应说明苯环中含有的并不是碳碳双键 |
| D、反应①、②中的所有有机物均可使溴水褪色,但褪色原理不完全相同 |
向一定量的Cu、Fe203的混合物中加人600mL 2mol/L的盐酸,恰好使混合物完全溶解,所得溶液中不含Fe3+,再加入过量1mol/L NaOH溶液,将沉淀过滤、洗涤、干燥,称得质量比原混合物增重17.6g,若用过量的CO在高温下还原相同质量的原混合物,固体减少的质量是( )
| A、4.8 g |
| B、8.8 g |
| C、9.6g |
| D、14.4g |
在空气中久置而不易变质的物质是( )
| A、过氧化钠 | B、纯碱 |
| C、硅酸钠溶液 | D、氯化亚铁溶液 |