题目内容
下列操作不能实现实验目的是( )
| A.目的:模拟工业上电解饱和食盐水 | B.目的:配制银氨溶液 |
 |
 |
| C.目的:比较Al、Fe、Cu活动性 | D.目的:实验室制取氨气 |
 |
 |
| A、A | B、B | C、C | D、D |
考点:化学实验方案的评价
专题:实验评价题
分析:A.电解饱和食盐水,应用惰性电极作阳极;
B.配制银氨溶液,应将氨水滴加到硝酸银溶液中;
C.形成原电池反应时,活泼金属为负极;
D.实验室用氯化铵和氢氧化钙在加热条件下制备氨气,氨气密度比空气小.
B.配制银氨溶液,应将氨水滴加到硝酸银溶液中;
C.形成原电池反应时,活泼金属为负极;
D.实验室用氯化铵和氢氧化钙在加热条件下制备氨气,氨气密度比空气小.
解答:
解:A.电解饱和食盐水,应用惰性电极作阳极,用石墨作阳极,铜作阴极,可电解,故A正确;
B.配制银氨溶液,应将氨水滴加到硝酸银溶液中,当生成的沉淀完全溶解时,可停止滴加氨水,故B错误;
C.形成原电池反应时,活泼金属为负极,可根据电极反应现象比较金属的活泼性,故C正确;
D.实验室用氯化铵和氢氧化钙在加热条件下制备氨气,氨气密度比空气小,用向下排空法收集,故D正确.
故选B.
B.配制银氨溶液,应将氨水滴加到硝酸银溶液中,当生成的沉淀完全溶解时,可停止滴加氨水,故B错误;
C.形成原电池反应时,活泼金属为负极,可根据电极反应现象比较金属的活泼性,故C正确;
D.实验室用氯化铵和氢氧化钙在加热条件下制备氨气,氨气密度比空气小,用向下排空法收集,故D正确.
故选B.
点评:本题考查较为综合,涉及物质的电解、溶液的配制、原电池以及氨气的制备等知识,综合考查学生的分析能力、实验能力和评价能力,为高考常见题型,注意把握物质的性质的异同以及实验的严密性和可行性的评价,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列两组热化学方程式中,有关△H的比较正确的是( )
①CH4(g)+2O2(g)═CO2(g)+2H2O(g);△H1
CH4(g)+2O2(g)═CO2(g)+2H2O(l);△H2
②NaOH(aq)+
H2SO4(浓)═
Na2SO4(aq)+H2O(l);△H3
NaOH(aq)+CH3COOH(aq)═CH3COONa(aq)+H2O(l);△H4.
①CH4(g)+2O2(g)═CO2(g)+2H2O(g);△H1
CH4(g)+2O2(g)═CO2(g)+2H2O(l);△H2
②NaOH(aq)+
| 1 |
| 2 |
| 1 |
| 2 |
NaOH(aq)+CH3COOH(aq)═CH3COONa(aq)+H2O(l);△H4.
| A、△H1>△H2;△H3>△H4 |
| B、△H1>△H2;△H3<△H4 |
| C、△H1=△H2;△H3<△H4 |
| D、△H1<△H2;△H3>△H4 |
设NA为阿伏加德罗常数的值,下列有关叙述正确的是( )
| A、0.1mol NH3溶于足量水中(不考虑氨气挥发),溶液中N原子的数目为0.1NA |
| B、在常温下,若CO与CO2的体积相等,则它们的物质的量相等 |
| C、标准状况下,22.4L NO与CO2的混合气体中含有O的原子数为3NA |
| D、在常温常压下,22.4L氢气的质量为2g |
已知A、B、C、D、E是短周期中原子序数依次增大的5种元素,A在反应中既不容易得电子也不容易失电子,元素B的最外层电子数是电子层数的3倍,元素D与A为同族元素,元素C和E形成的化合物CE是海水中的主要成分.下列说法不正确的是( )
| A、离子半径:r(E)>r(B)>r(C) |
| B、熔点:CE>DE4 |
| C、C与B形成的两种化合物中化学键类型不同 |
| D、A、D、E的最高价氧化物对应水化物的酸性逐渐增强 |
阿维A酯是一种皮肤病用药,可由原料X经过多步反应合成:

下列叙述正确的是( )

下列叙述正确的是( )
| A、有机物X与Y互为同系物 |
| B、有机物Y与阿维A酯均能与NaOH溶液反应 |
| C、一定条件下1mol阿维A酯能与4mol H2发生加成反应 |
| D、X中有6种化学环境不同的氢原子,Y中有1个手性碳原子 |
下列有关实验操作或现象的描述正确的是( )
| A、制备Fe(OH)3胶体时,溶液呈红褐色停止加热 |
| B、分馏实验中,温度计的水银球必须置于液面以下 |
| C、向饱和CuSO4溶液中加入少量浓硫酸,析出白色固体 |
| D、乙酸乙酯的制备实验中,将蒸气通到饱和NaOH溶液液面之上 |
粗制的CuSO4?5H2O晶体中含有Fe2+.提纯时,为了除去Fe2+,常加入少量H2O2,然后再加入少量碱至溶液pH=4,可以达到除去铁离子而不损失硫酸铜的目的.下列说法不正确的是( )
| A、溶解CuSO4?5H2O晶体时要加入少量稀H2SO4 |
| B、加入H2O2,将Fe2+氧化,2Fe2++H2O2+2H+═2Fe3++2H2O |
| C、由于CuSO4的催化作用,会使部分H2O2分解而损失 |
| D、调溶液pH=4的依据是Cu(OH)2比Fe(OH)3更难溶 |
 如图是一水溶液在pH从0到14的范围内,H2CO3、HCO3-、CO32-三种成分平衡时的组成分数,下列叙述正确的是( )
如图是一水溶液在pH从0到14的范围内,H2CO3、HCO3-、CO32-三种成分平衡时的组成分数,下列叙述正确的是( )| A、此图是1.0mol/L碳酸钠溶液滴定1.0mol/L HCl溶液的滴定曲线 |
| B、在pH为6.37及10.25时,溶液中c(H2CO3)=c(HCO3-)=c(CO32-) |
| C、人体血液的pH约为7.4,则CO2在血液中多以HCO3-的形式存在 |
| D、若用CO2和NaOH反应制取Na2CO3,溶液的pH必须控制在12以上 |
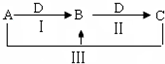 A、B、C、D都是中学化学中常见物质,其中A、B、C均含有同一种元素,在一定条件下相互转化关系如图(部分反应中的水已略去).
A、B、C、D都是中学化学中常见物质,其中A、B、C均含有同一种元素,在一定条件下相互转化关系如图(部分反应中的水已略去).