题目内容
实验室需要0.2mol?L-1的NaOH溶液480mL.请回答:
(1)配制溶液时,一般可以分为以下几个步骤:
①称量 ②计算 ③溶解 ④倒转摇匀 ⑤转移 ⑥洗涤 ⑦定容 ⑧冷却
其正确的操作顺序为②① ⑦④.完成本实验除了托盘天平、药匙、烧杯、玻璃棒外、还必须用到的玻璃仪器有 、 .
(2)某同学欲称量一定量的NaOH固体,他先用托盘天平称量烧杯的质量,天平平衡后的状态如图.烧杯的实际质量为 g,该同学应称量 g NaOH.

(3)使用容量瓶前必须进行的一步操作是 .
(4)如果其他操作都正确,下列操作会引起浓度偏高的是 (填序号).
①没有洗涤烧杯和玻璃棒
②转移溶液时不慎有少量溶液洒到容量瓶外面
③容量瓶不干燥,含有少量蒸馏水
④定容时仰视刻度线
⑤未冷却就定容.
(1)配制溶液时,一般可以分为以下几个步骤:
①称量 ②计算 ③溶解 ④倒转摇匀 ⑤转移 ⑥洗涤 ⑦定容 ⑧冷却
其正确的操作顺序为②①
(2)某同学欲称量一定量的NaOH固体,他先用托盘天平称量烧杯的质量,天平平衡后的状态如图.烧杯的实际质量为

(3)使用容量瓶前必须进行的一步操作是
(4)如果其他操作都正确,下列操作会引起浓度偏高的是
①没有洗涤烧杯和玻璃棒
②转移溶液时不慎有少量溶液洒到容量瓶外面
③容量瓶不干燥,含有少量蒸馏水
④定容时仰视刻度线
⑤未冷却就定容.
考点:配制一定物质的量浓度的溶液
专题:实验题
分析:(1)根据配制步骤是计算、称量、溶解、冷却、移液、洗涤、定容、摇匀、装瓶来对操作顺序进行排序;根据配制步骤是计算、称量、溶解、移液、洗涤、定容、摇匀、装瓶来分析需要的仪器;
(2)根据托盘天平的称量原理计算出烧杯的实际质量;根据m=nM=cVM计算需要氢氧化钠的质量;
(3)根据容量瓶的构造及正确使用方法进行判断;
(4)根据c=
可得,一定物质的量浓度溶液配制的误差都是由溶质的物质的量n和溶液的体积V引起的,误差分析时,关键要看配制过程中引起n和V怎样的变化:若n比理论值小,或V比理论值大时,都会使所配溶液浓度偏小;若n比理论值大,或V比理论值小时,都会使所配溶液浓度偏大;
(2)根据托盘天平的称量原理计算出烧杯的实际质量;根据m=nM=cVM计算需要氢氧化钠的质量;
(3)根据容量瓶的构造及正确使用方法进行判断;
(4)根据c=
| n |
| V |
解答:
解:(1)实验室中没有480mL的容量瓶,配制时需要选用500mL的容量瓶,配制500mL0.2mol/L的NaOH溶液的步骤为:计算→称量→溶解、冷却→移液→定容→摇匀→装瓶→贴签,一般用天平称量(用到药匙)称量,在烧杯中溶解,冷却后转移到500mL容量瓶中,并用玻璃棒引流,转移完毕,用少量蒸馏水洗涤烧杯及玻璃棒2~3次并将洗涤液全部转移到容量瓶中,再加适量蒸馏水,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,使溶液的凹液面的最低点与刻线相平,塞好瓶塞,反复上下颠倒摇匀,所以正确的操作顺序为:②①③⑧⑤⑥⑤⑦④.;需要的仪器为:托盘天平、药匙、烧杯、玻璃棒、500mL容量瓶、胶头滴管,还缺少500mL容量瓶,
故答案为:②①③⑧⑤⑥⑦④;500ml容量瓶、胶头滴管;
(2)根据图示可知,游码的读数为2.6g,结合托盘天平的称量原理可知,图示中,砝码质量=烧杯质量+游码质量,所以烧杯质量=砝码质量-游码质量=20g-2.6g=17.4g;配制500mL0.2mol/L的NaOH溶液,需要氢氧化钠的质量为:0.5L×0.2mol/L×40g/mol=4.0g,
故答案为:17.4;4.0;
(3)容量瓶有瓶塞,配制过程中需要摇匀,为了避免液体流出,配制溶液之前需要据此容量瓶是否漏水,
故答案为:检验容量瓶是否漏水;
(4)①没有洗涤烧杯和玻璃棒,将导致溶质的损失,配制的溶液中溶质的物质的量偏小,配制的溶液浓度偏低,故①错误;
②转移溶液时不慎有少量溶液洒到容量瓶外面,将导致溶质的损失,配制的溶液中溶质的物质的量偏小,配制的溶液浓度偏低,故②错误;
③若容量瓶未干燥即用来配制溶液,对溶液浓度无影响,因为只要定容时正确,至于水是原来就有的还是后来加入的,对浓度无影响,故③错误;
④定容时仰视刻度线,则溶液体积偏大,则浓度偏低,故④错误;
⑤未冷却就定容,则冷却后溶液体积偏小,浓度偏高,故⑤正确.
故选⑤.
故答案为:②①③⑧⑤⑥⑦④;500ml容量瓶、胶头滴管;
(2)根据图示可知,游码的读数为2.6g,结合托盘天平的称量原理可知,图示中,砝码质量=烧杯质量+游码质量,所以烧杯质量=砝码质量-游码质量=20g-2.6g=17.4g;配制500mL0.2mol/L的NaOH溶液,需要氢氧化钠的质量为:0.5L×0.2mol/L×40g/mol=4.0g,
故答案为:17.4;4.0;
(3)容量瓶有瓶塞,配制过程中需要摇匀,为了避免液体流出,配制溶液之前需要据此容量瓶是否漏水,
故答案为:检验容量瓶是否漏水;
(4)①没有洗涤烧杯和玻璃棒,将导致溶质的损失,配制的溶液中溶质的物质的量偏小,配制的溶液浓度偏低,故①错误;
②转移溶液时不慎有少量溶液洒到容量瓶外面,将导致溶质的损失,配制的溶液中溶质的物质的量偏小,配制的溶液浓度偏低,故②错误;
③若容量瓶未干燥即用来配制溶液,对溶液浓度无影响,因为只要定容时正确,至于水是原来就有的还是后来加入的,对浓度无影响,故③错误;
④定容时仰视刻度线,则溶液体积偏大,则浓度偏低,故④错误;
⑤未冷却就定容,则冷却后溶液体积偏小,浓度偏高,故⑤正确.
故选⑤.
点评:本题考查了一定物质的量浓度溶液的配制过程中的计算和误差分析,属于基础型题目,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
用如图所示装置探究碳酸和苯酚的酸性强弱,下列叙述不正确的是(部分夹持仪器省略)( )


| A、②中试剂为饱和NaHCO3溶液 |
| B、打开分液漏斗旋塞,①中产生无色气泡,③中出现白色浑浊 |
| C、苯酚有弱酸性,是由于苯基影响了与其相连的羟基的活性 |
D、③中发生反应的化学方程式是 |
下列说法正确的是( )
| A、用加热法可除去Na2CO3中的NaHCO3 |
| B、Na、Mg、Fe等金属在一定条件下与水反应都生成H2和对应的碱 |
| C、可用石灰水区分Na2CO3与NaHCO3溶液 |
| D、浓氨水中滴加FeCl3饱和溶液可制得Fe(OH)3胶体 |
下列叙述不正确的是( )
| A、石油的裂化和裂解可以得到烯烃 |
| B、石油的催化重整是获得芳香烃的主要途径 |
| C、石油分馏出的各馏分均是纯净物 |
| D、煤干馏产生的煤焦油经分馏可得到芳香烃 |
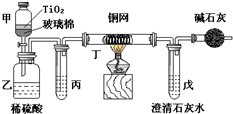 电镀厂曾采用有氰电镀工艺,由于排放的废水中含有的剧毒CN-离子,而逐渐被无氰电镀工艺替代.处理有氰电镀的废水时,可在催化剂TiO2作用下,先用NaClO将CN-离子氧化成OCN-,再在酸性条件下继续被NaClO氧化成N2和CO2.环保工作人员在密闭系统中用如图装置进行实验,以证明处理方法的有效性,并测定CN-被处理的百分率.将浓缩后含CN-离子的污水与过量NaClO溶液的混合液共200mL(其中CN-的浓度为0.05mol?L-1)倒入甲中,塞上橡皮塞,一段时间后,打开橡皮塞和活塞,使溶液全部放入乙中,关闭活塞.回答下列问题:
电镀厂曾采用有氰电镀工艺,由于排放的废水中含有的剧毒CN-离子,而逐渐被无氰电镀工艺替代.处理有氰电镀的废水时,可在催化剂TiO2作用下,先用NaClO将CN-离子氧化成OCN-,再在酸性条件下继续被NaClO氧化成N2和CO2.环保工作人员在密闭系统中用如图装置进行实验,以证明处理方法的有效性,并测定CN-被处理的百分率.将浓缩后含CN-离子的污水与过量NaClO溶液的混合液共200mL(其中CN-的浓度为0.05mol?L-1)倒入甲中,塞上橡皮塞,一段时间后,打开橡皮塞和活塞,使溶液全部放入乙中,关闭活塞.回答下列问题: