题目内容
15.有a、b、c、d四个金属电极,G为电流计.有关的反应装置及部分反应现象如下:| 实验 装置 | 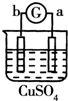 | 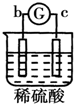 | 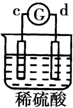 | 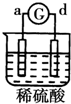 |
| 部分实验现象 | a极质量减小b极质量增加 | 溶液中的SO42-向b极移动 | d极溶解c极有气体产生 | 电子从d极流向 a极 |
| A. | d>a>b>c | B. | a>b>c>d | C. | b>c>d>a | D. | a>b>d>c |
分析 形成原电池时,活泼金属作负极,不活泼金属作正极,负极逐渐溶解,正极上有气泡生成或有金属析出,电子从负极经外电路流向正极,溶液中阴离子向负极移动,据此来回答判断.
解答 解:a极质量减小b极质量增加,则a为负极,b为正极,所以金属的活动性顺序a>b;
溶液中的SO42-向b极移动,则b为负极,c为正极,所以金属的活动性顺序b>c;
d极溶解,所以d是负极,c极有气体产生,所以c是正极,所以金属的活动性顺序d>c;
电子从d极流向a极,a极为正极,d极为负极,所以金属的活动性顺序d>a;
所以这四种金属的活动性顺序d>a>b>c.
故选A.
点评 本题主要考查了金属的活动性强弱比较,侧重于原电池原理的应用考查,注意原电池中活泼性强的做负极,明确原电池中正负极的判断方法是解题的关键,题目难度不大.

练习册系列答案
相关题目
5.下列溶液中能够区别SO2和CO2气体的是( )
①澄清石灰水 ②H2S溶液 ③KMnO4酸性溶液 ④NaHCO3溶液 ⑤品红溶液.
①澄清石灰水 ②H2S溶液 ③KMnO4酸性溶液 ④NaHCO3溶液 ⑤品红溶液.
| A. | 只有①②③ | B. | 只有②③⑤ | C. | ②③④⑤ | D. | ①②③⑤ |
6.下列实验中,用错试剂的是( )
| A. | 用稀盐酸清洗做焰色反应的铂丝 | B. | 用酒精萃取碘水中的碘 | ||
| C. | 用稀硝酸洗去残留在试管壁上的铜 | D. | 用氢氟酸刻蚀玻璃 |
3.向60mL 18mol•L-1的H2SO4溶液中加入足量的铜片并加热,充分反应后被还原的硫酸的物质的量为( )
| A. | 1.08mol | B. | 小于0.54mol | ||
| C. | 在0.54~1.08mol之间 | D. | 大于0.54mol |
10.下列操作不能达到目的是( )
| 选项 | 目的 | 操作 |
| A | 配制80mL 1.0mol•L-1CuSO4溶液 | 将25g CuSO4•5H2O溶于蒸馏水配制成100mL溶液 |
| B | 除去KCl中少量KClO3 | 将混合物(加少量MnO2)置于坩埚中灼烧至固体质量不再减少 |
| C | 在溶液中将MnO4-完全转化为Mn2+ | 向酸性KMnO4溶液中滴加H2O2溶液至紫色消失 |
| D | 确定NaCl溶液中是否混有Na2CO3 | 取少量溶液滴加CaCl2溶液,观察是否出现白色浑浊 |
| A. | A、 | B. | B、 | C. | C、 | D. | D、 |
20.室温下,下列各组离子能大量共存的是( )
| A. | 通入大量CO2的溶液中:K+、ClO-、SO32-、HCO3- | |
| B. | 能使蓝色石蕊试纸变红色的溶液中:K+、Na+、CO32-、NO3- | |
| C. | 含有较多Al3+的溶液:Na+、SO42-、I-、ClO- | |
| D. | c(H+):c(OH-)=1:1012的水溶液中:CO32-、Na+、NO3-、AlO2- |
7.下列有关实验的说法正确的是( )
| A. | 在测定中和反应的反应热实验中,要读取两次温度 | |
| B. | 可用pH试纸测定新制氯水的pH | |
| C. | 中和滴定实验中,洗净后的锥形瓶不需要干燥 | |
| D. | 向白色ZnS沉淀上滴加CuSO4溶液,沉淀变为黑色,说明Ksp(ZnS)<Ksp(CuS) |
4.下列关于Al及其化合物的性质描述正确的是( )
| A. | 金属铝能够在空气中稳定存在是因为其在常温下不与氧气反应 | |
| B. | 氧化铝与NaOH溶液的反应体现了氧化铝的酸性氧化物的特性 | |
| C. | 明矾的水溶液具有“净水、杀菌消毒”的作用 | |
| D. | 氢氧化铝是两性氢氧化物,其“两性”是指既具有氧化性,又具有还原性 |
5.铁镍蓄电池,放电时的总反应为:Fe+Ni2O3+3H2O$?_{充电}^{放电}$Fe(OH)2+2Ni(OH)2下列有关该电池的说法不正确的是( )
| A. | 电池的电解液为碱性溶液,正极为Ni 2O 3、负极为Fe | |
| B. | 电池放电时,负极反应为Fe+2OH --2e -═Fe(OH) 2 | |
| C. | 电池充电过程中,阴极附近溶液的pH降低 | |
| D. | 电池充电时,阳极反应为2Ni(OH) 2+2OH --2e -═Ni 2O 3+3H 2O |