题目内容
甲柜 | 乙柜 | 丙柜 | 丁柜 | 戊柜 |
盐酸、硫酸 | 烧碱、氢氧化钡 | 硫、红磷 | 铜、锌 | 碳酸钠、硝酸钾 |
现在新购进硝酸、苛性钾、碘和硝酸银溶液,下列对其保存方法不正确的是( )
A.硝酸装进棕色细口瓶放在甲柜 B.苛性钾固体用磨口玻璃塞广口瓶放在乙柜
C.碘单质用广口瓶装放在丙柜 D.硝酸银溶液用棕色磨口细口瓶放在戊柜
练习册系列答案
相关题目
7.将0.2mol•L-1的KI溶液和0.05mol•L-1 Fe2(SO4)3溶液等体积混合充分反应后,取混合液分别完成下列实验,能说明溶液中存在化学平衡2Fe3++2I-═2Fe2++I2的是( )
| 实验编号 | 实验操作 | 实验现象 |
| ① | 滴入KSCN溶液 | 溶液变红色 |
| ② | 滴入AgNO3溶液 | 有黄色沉淀生成 |
| ③ | 滴入K3[Fe(CN)6]溶液 | 有蓝色沉淀生成 |
| ④ | 滴入淀粉溶液 | 溶液变蓝色 |
| A. | ②和④ | B. | ①和③ | C. | ③和④ | D. | ① |
4. 乙苯(
乙苯(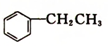 )在有机合成中占有重要的地位,有着广泛的用途.
)在有机合成中占有重要的地位,有着广泛的用途.
已知:① (g)+HCl(g)?
(g)+HCl(g)? (g)△H1=-54kJ•mol-1
(g)△H1=-54kJ•mol-1
② (g)+H2(g)?
(g)+H2(g)? (g)△H2=-121kJ•mol-1
(g)△H2=-121kJ•mol-1
③H2(g)+Cl2(g)═2HCl(g),△H3=-185kJ•mol-1
④相关化学键的键能数据如表所示:
请回答:
(1)根据化学反应原理,缩小容器容积对反应②的影响为缩小容器容积反应速率加快,平衡正向进行,反应物转化率增大;
(2)根据反应①和表中数据计算,x=615;
(3) (g)+Cl2(g)?
(g)+Cl2(g)? (g)+HCl(g)△H4
(g)+HCl(g)△H4
①△H4=-118KJ/mol;
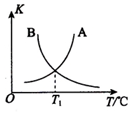
②该反应正、逆反应平衡常数与温度的关系如图所示,其中表示正反应平衡常数K正的曲线为B(填“A”或“B”),理由为反应正反应为放热反应,升温平衡逆向进行平衡常数减小;
③T1℃时,该反应的平衡常数K=1,该温度下,起始向容积为10L的容积可变的密闭容器中充入1mol (g)、2mol Cl2(g)、1mol
(g)、2mol Cl2(g)、1mol  (g)、2mol HCl(g),则开始时,v正=(填“>”、“<”或“=”)v逆.
(g)、2mol HCl(g),则开始时,v正=(填“>”、“<”或“=”)v逆.
 乙苯(
乙苯(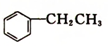 )在有机合成中占有重要的地位,有着广泛的用途.
)在有机合成中占有重要的地位,有着广泛的用途.已知:①
 (g)+HCl(g)?
(g)+HCl(g)? (g)△H1=-54kJ•mol-1
(g)△H1=-54kJ•mol-1②
 (g)+H2(g)?
(g)+H2(g)? (g)△H2=-121kJ•mol-1
(g)△H2=-121kJ•mol-1③H2(g)+Cl2(g)═2HCl(g),△H3=-185kJ•mol-1
④相关化学键的键能数据如表所示:
| 化学键 | C-H | C-C | C=C | C-Cl | H-Cl |
| 键能/(kJ•mol-1) | 412 | 348 | X | 341 | 432 |
(1)根据化学反应原理,缩小容器容积对反应②的影响为缩小容器容积反应速率加快,平衡正向进行,反应物转化率增大;
(2)根据反应①和表中数据计算,x=615;
(3)
 (g)+Cl2(g)?
(g)+Cl2(g)? (g)+HCl(g)△H4
(g)+HCl(g)△H4①△H4=-118KJ/mol;
②该反应正、逆反应平衡常数与温度的关系如图所示,其中表示正反应平衡常数K正的曲线为B(填“A”或“B”),理由为反应正反应为放热反应,升温平衡逆向进行平衡常数减小;
③T1℃时,该反应的平衡常数K=1,该温度下,起始向容积为10L的容积可变的密闭容器中充入1mol
 (g)、2mol Cl2(g)、1mol
(g)、2mol Cl2(g)、1mol  (g)、2mol HCl(g),则开始时,v正=(填“>”、“<”或“=”)v逆.
(g)、2mol HCl(g),则开始时,v正=(填“>”、“<”或“=”)v逆.
19.在给定条件下,下列选项中物质间的转化均能一步实现的是( )
| A. | S$\stackrel{O_{2}}{→}$SO2$\stackrel{H_{2}O}{→}$H2SO4 | |
| B. | Al3+$\stackrel{过量氨水}{→}$AlO${\;}_{2}^{-}$$\stackrel{CO_{2}}{→}$Al(OH)3 | |
| C. | NaCl(aq)$\stackrel{电解}{→}$Na$\stackrel{O_{2}}{→}$Na2O2 | |
| D. | Fe$\stackrel{稀H_{2}SO_{4}}{→}$FeSO4(aq) $\stackrel{NaOH(aq)}{→}$Fe(OH)2 |
2.H2是一种很有前途的能源,以水为原料大量制取H2,最理想的途径是( )
| A. | 在光分解催化剂存在下,利用太阳能分解水制H2 | |
| B. | 以焦炭和水为原料制水煤气后再分离出H2 | |
| C. | 以金属钠与水反应生成H2 | |
| D. | 由热电站提供电力电解水产生H2 |
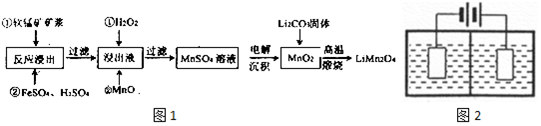
3.新型锂电池正极材料锰酸锂(LiMn2O4)有望取代广泛使用的LiCoO2.工业上用某软锰矿(主要成分为MnO2,同时含有少量铁、铝及硅等的氧化物)为原料制备锰酸锂的流程如图1:
有关物质的溶度积常数
(1)已知,锂电池放电正极的电极反应为:LiMn2O4+e-+Li+═Li2Mn2O4,则锂电池正极材料锰酸锂中,锰元素的化合价为+3、+4.
(2)流程中,FeSO4的作用是作还原剂,还原MnO2,MnO的作用是调节滤液的pH,除去Fe3+和Al3+,当滤液中的pH为6时,滤液中所含铝离子的浓度为4.5×10-9mol•L-1.
(3)采用图2装置电解,离子交换膜将电解池分隔为阳极室和阴极室,两室的溶液分别为硫酸钠溶液和制得的硫酸锰溶液,则阴极室中的溶液为硫酸钠溶液;电解产生的MnO2沉积在电极上,该电极反应式为Mn2+-2e-+2H2O=MnO2+4H+.
(4)若将上述装置中的硫酸钠溶液换为软锰矿的矿浆,并加入适量的硫酸铁及硫酸,可一次性完成软锰矿的浸出反应与电解沉积MnO2反应,电解时,Fe3+先放电生成Fe2+,产生的Fe2+再与矿浆中的 MnO2反应,周而复始,直至矿浆中的MnO2完全浸出.则Fe2+与矿浆中MnO2反应的离子方程式为2Fe2++MnO2+44H+=2Fe3++Mn2++2H2O.
(5)写出高温煅烧生成锰酸锂的化学方程式8MnO2+2Li2CO3$\frac{\underline{\;高温\;}}{\;}$4LiMn2O4+2CO2↑+O2↑.

有关物质的溶度积常数
| 物质 | Fe(OH)2 | Fe(OH)3 | Al(OH)3 | Mn(OH)2 |
| Ksp | 8.0×10-16 | 4.0×l0-38 | 4.5×10-33 | 1.9×l0-13 |
(2)流程中,FeSO4的作用是作还原剂,还原MnO2,MnO的作用是调节滤液的pH,除去Fe3+和Al3+,当滤液中的pH为6时,滤液中所含铝离子的浓度为4.5×10-9mol•L-1.
(3)采用图2装置电解,离子交换膜将电解池分隔为阳极室和阴极室,两室的溶液分别为硫酸钠溶液和制得的硫酸锰溶液,则阴极室中的溶液为硫酸钠溶液;电解产生的MnO2沉积在电极上,该电极反应式为Mn2+-2e-+2H2O=MnO2+4H+.
(4)若将上述装置中的硫酸钠溶液换为软锰矿的矿浆,并加入适量的硫酸铁及硫酸,可一次性完成软锰矿的浸出反应与电解沉积MnO2反应,电解时,Fe3+先放电生成Fe2+,产生的Fe2+再与矿浆中的 MnO2反应,周而复始,直至矿浆中的MnO2完全浸出.则Fe2+与矿浆中MnO2反应的离子方程式为2Fe2++MnO2+44H+=2Fe3++Mn2++2H2O.
(5)写出高温煅烧生成锰酸锂的化学方程式8MnO2+2Li2CO3$\frac{\underline{\;高温\;}}{\;}$4LiMn2O4+2CO2↑+O2↑.





