题目内容
下列说法正确的是( )


| A、①表示化学反应2NO2(g)+O3(g)═N2O5(g)+O2(g)△H>0 |
| B、②表示25℃时,用0.1 mol/LCH3COOH溶液滴定20 mL 0.1 mol/LNaOH溶液,溶液的pH随加入酸体积的变化 |
| C、③表示10 mL 0.01 mol/L KMnO4酸性溶液与过量的0.1 mol/LH2C2O4溶液混合时,n (Mn2+)随时间的变化 |
| D、④表示体积和pH均相同的HCl和CH3COOH两种溶液中,分别加入足量的锌,产生H2的体积随时间的变化,则a表示CH3COOH溶液 |
考点:酸碱混合时的定性判断及有关ph的计算,化学反应的能量变化规律,氧化还原反应,弱电解质在水溶液中的电离平衡
专题:
分析:A、根据反应物和产物能量的相对高低判断反应的吸放热情况;
B、20mL0.1mol/LCH3COOH溶液和20 mL 0.1 mol/LNaOH溶液恰好反应,得到的醋酸钠溶液显示碱性;
C、反应生成的Mn2+对该反应有催化作用,反应速率越来越快;
D、酸的物质的量越大,则和金属锌反应产生的氢气的量越多.
B、20mL0.1mol/LCH3COOH溶液和20 mL 0.1 mol/LNaOH溶液恰好反应,得到的醋酸钠溶液显示碱性;
C、反应生成的Mn2+对该反应有催化作用,反应速率越来越快;
D、酸的物质的量越大,则和金属锌反应产生的氢气的量越多.
解答:
解:A、根据图示可以知道:反应物的能量高于产物的,所以反应是放热的,即△H<0,故A错误;
B、20mL0.1mol/LCH3COOH溶液和20 mL 0.1 mol/LNaOH溶液恰好反应,得到的醋酸钠溶液显示碱性,pH大于7,和图中的pH=7不相符,故B错误;
C、虽反应是放热反应,但反应生成的Mn2+对该反应有催化作用,故反应速率越来越快,故C错误;
D、体积和pH均相同的HCl和CH3COOH两种溶液中,醋酸的物质的量较大,所以分别加入足量的锌,CH3COOH溶液产生H2的体积较大,故D正确.
故选D.
B、20mL0.1mol/LCH3COOH溶液和20 mL 0.1 mol/LNaOH溶液恰好反应,得到的醋酸钠溶液显示碱性,pH大于7,和图中的pH=7不相符,故B错误;
C、虽反应是放热反应,但反应生成的Mn2+对该反应有催化作用,故反应速率越来越快,故C错误;
D、体积和pH均相同的HCl和CH3COOH两种溶液中,醋酸的物质的量较大,所以分别加入足量的锌,CH3COOH溶液产生H2的体积较大,故D正确.
故选D.
点评:本题综合考查学生弱电解质的电离以及化学反应的能量变化、酸碱混合的计算等知识,注意知识的归纳和梳理是解题的关键,难度中等.

练习册系列答案
相关题目
a g Mg、Al合金完全溶解在C1 mol?L-1、V1L HCl溶液中,产生b g H2.再向反应后的溶液中加入C2mol?L-1、V2L NaOH溶液,恰好使沉淀达到最大值,且沉淀质量为d g.下列关系错误的是( )
A、铝为
| ||
B、C1=
| ||
| C、d=a+17b | ||
| D、与金属反应后剩余盐酸为(C1V1-b)mol |
苹果醋是一种由苹果发酵而形成的具有解毒、降脂、减肥等明显药效的健康食品.苹果酸(2羟基丁二酸)是这种饮料的主要酸性物质,苹果酸的结构简式为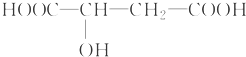 .下列相关说法不正确的是( )
.下列相关说法不正确的是( )
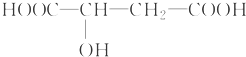 .下列相关说法不正确的是( )
.下列相关说法不正确的是( )| A、苹果酸在一定条件下能发生酯化反应 |
| B、苹果酸在一定条件下能发生催化氧化反应 |
| C、1 mol苹果酸与足量Na反应生成33.6 L H2(标准状况下) |
| D、1 mol苹果酸与Na2CO3溶液反应一定消耗2 mol Na2CO3 |
下列叙述或操作正确的是( )
| A、浓硫酸具有强氧化性,稀硫酸无氧化性 |
| B、浓硫酸滴到蓝矾上,蓝矾变成白色粉末,体现了浓硫酸的脱水性 |
| C、稀释浓硫酸时应将浓硫酸沿着烧杯壁慢慢地注入盛有水的烧杯中,并不断搅拌 |
| D、浓硫酸与铜的反应中,浓硫酸仅表现强氧化性 |
下列各组给定原子序数的元素,不能形成原子数之比为1:1稳定化合物的是( )
| A、3和17 | B、1和8 |
| C、1和9 | D、17和12 |
在蒸发皿中加热蒸干下列物质的溶液,再灼烧可以得到原溶质固体的是( )
| A、AlCl3 |
| B、NaHCO3 |
| C、MgSO4 |
| D、KMnO4 |
下列过程中,共价键被破坏的是( )
| A、碘升华 |
| B、溴溶于CCl4 |
| C、蔗糖溶于水 |
| D、HCl溶于水 |
 在密闭容器中,一边装有一定量的金属钠,一边装有一定量的氧化汞,同时加热容器的两部分,钠和氧化汞都完全反应后,恢复到原温度,容器内空气的成分仍不变.则钠和氧化汞的物质的量之比是
在密闭容器中,一边装有一定量的金属钠,一边装有一定量的氧化汞,同时加热容器的两部分,钠和氧化汞都完全反应后,恢复到原温度,容器内空气的成分仍不变.则钠和氧化汞的物质的量之比是