题目内容
硫酸渣是用黄铁矿制造硫酸过程中排出的废渣,主要化学成分为SiO2(约45%)、Fe2O3(约40%)、Al2O3(约10%)和MgO(约5%).某同学设计了如图1方案,分离样品中各种金属元素.请回答下列问题.
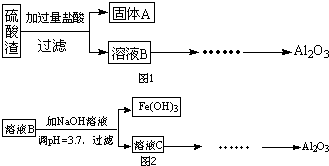 (1)写出溶液B的溶质是 .
(1)写出溶液B的溶质是 .
(2)参照如图2形式进一步完成“溶液C”到“Al2O3”的流程(注明试剂、条件和操作) .
(3)为了分析某硫酸渣中铁元素的含量,先将硫酸渣预处理,把铁元素还原成Fe2+,再用KMnO4标准溶液在酸性条件下进行氧化还原滴定.写出反应的离方程式: .
 (1)写出溶液B的溶质是
(1)写出溶液B的溶质是(2)参照如图2形式进一步完成“溶液C”到“Al2O3”的流程(注明试剂、条件和操作)
(3)为了分析某硫酸渣中铁元素的含量,先将硫酸渣预处理,把铁元素还原成Fe2+,再用KMnO4标准溶液在酸性条件下进行氧化还原滴定.写出反应的离方程式:
考点:金属的回收与环境、资源保护
专题:实验设计题
分析:(1)溶液B是废渣主要化学成分为SiO2(约45%)、Fe2O3(约40%)、Al2O3(约10%)和MgO(约5%),溶于过量盐酸反应后过滤得到的溶液中溶质;
(2)依据废渣溶于过量盐酸得到溶液B中含有溶质为:MgCl2、AlCl3、FeCl3和过量HCl;B溶液中加入氢氧化钠溶液,调节溶液PH=3.7后,生成氢氧化铁沉淀;和滤液MgCl2、AlCl3和过量HCl;在加入过量氢氧化钠溶液,过滤得到滤液中为NaCl,NaAlO2;通入二氧化碳气体生成氢氧化铝沉淀,过滤得到氢氧化铝沉淀,灼烧得到Al2O3;依据流程图画出;
(3)根据KMnO4溶液具有强氧化性,把二价铁氧化成三价铁,本身被还原成二价锰离子结合得失电子守恒配平;
(2)依据废渣溶于过量盐酸得到溶液B中含有溶质为:MgCl2、AlCl3、FeCl3和过量HCl;B溶液中加入氢氧化钠溶液,调节溶液PH=3.7后,生成氢氧化铁沉淀;和滤液MgCl2、AlCl3和过量HCl;在加入过量氢氧化钠溶液,过滤得到滤液中为NaCl,NaAlO2;通入二氧化碳气体生成氢氧化铝沉淀,过滤得到氢氧化铝沉淀,灼烧得到Al2O3;依据流程图画出;
(3)根据KMnO4溶液具有强氧化性,把二价铁氧化成三价铁,本身被还原成二价锰离子结合得失电子守恒配平;
解答:
解:(1)废渣主要化学成分为SiO2(约45%)、Fe2O3(约40%)、Al2O3(约10%)和MgO(约5%);加入过量盐酸,Fe2O3碱性氧化物,Al2O3两性氧化物、MgO碱性氧化物都和过量的盐酸反应生成的溶液中含有溶质为:MgCl2、AlCl3、FeCl3和过量HCl;故答案为:MgCl2、AlCl3、FeCl3、HCl;
(2)依据废渣溶于过量盐酸得到溶液B中含有溶质为:MgCl2、AlCl3、FeCl3和过量HCl;B溶液中加入氢氧化钠溶液,调节溶液PH=3.7后,生成氢氧化铁沉淀;和滤液MgCl2、AlCl3和过量HCl;在加入过量氢氧化钠溶液,过滤得到滤液中为NaCl,NaAlO2;通入二氧化碳气体生成氢氧化铝沉淀,过滤得到氢氧化铝沉淀,灼烧得到Al2O3;依据流程图画出;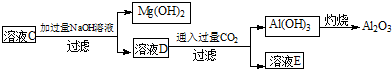 ,
,
故答案为: ;
;
(3)KMnO4溶液具有强氧化性,把二价铁氧化成三价铁,本身被还原成二价锰离子,再根据得失电子守恒配平,则离子方程式为:5Fe2++MnO4_+8H+=5Fe3++Mn2++4H2O,故答案为:5Fe2++MnO4_+8H+=5Fe3++Mn2++4H2O;
(2)依据废渣溶于过量盐酸得到溶液B中含有溶质为:MgCl2、AlCl3、FeCl3和过量HCl;B溶液中加入氢氧化钠溶液,调节溶液PH=3.7后,生成氢氧化铁沉淀;和滤液MgCl2、AlCl3和过量HCl;在加入过量氢氧化钠溶液,过滤得到滤液中为NaCl,NaAlO2;通入二氧化碳气体生成氢氧化铝沉淀,过滤得到氢氧化铝沉淀,灼烧得到Al2O3;依据流程图画出;
 ,
,故答案为:
 ;
;(3)KMnO4溶液具有强氧化性,把二价铁氧化成三价铁,本身被还原成二价锰离子,再根据得失电子守恒配平,则离子方程式为:5Fe2++MnO4_+8H+=5Fe3++Mn2++4H2O,故答案为:5Fe2++MnO4_+8H+=5Fe3++Mn2++4H2O;
点评:本题考查了设计流程分离物质,试剂选择和反应现象,反应特征的应用,氧化还原反应方程式的书写,题目难度中等.

练习册系列答案
 备战中考寒假系列答案
备战中考寒假系列答案
相关题目
在水溶液中能大量共存的一组离子是( )
| A、K+、Ba2+、NO3-、Cl- |
| B、H+、Fe2+、ClO-、Cl- |
| C、Na+、Ag+、Cl-、SO42- |
| D、Al3+、Na+、HCO3-、SO42- |
由钠和氧组成的某种离子晶体含钠的质量分数是69/109,其阴离子只有过氧离子(O22-)和氧离子(O2-)两种.在此晶体中,氧离子和超氧离子的物质的量之比为( )
| A、2:1 | B、1:2 |
| C、1:1 | D、1:3 |
 实验结束后,碳棒上的白色物质变为红色,无水硫酸铜不变色.
实验结束后,碳棒上的白色物质变为红色,无水硫酸铜不变色.