题目内容
2.下列物质的转化在给定条件下能实现的是( )①NaAlO2(aq)$\stackrel{过量盐酸}{→}$AlCl3$\stackrel{电解}{→}$Al
②NH3$→_{△}^{O_{2}/催化剂}$NO$\stackrel{O_{2}、H_{2}O}{→}$ HNO3
③NaCl(饱和溶液)$\stackrel{NH_{3}、CO_{2}}{→}$NaHCO3$\stackrel{△}{→}$Na2CO3
④FeS2$\stackrel{燃烧}{→}$SO3$\stackrel{H_{2}O}{→}$H2SO4.
| A. | ②③ | B. | ①④ | C. | ②④ | D. | ③④ |
分析 ①氯化铝为共价化合物,不能用于冶炼铝;
②氨气催化氧化生成NO.NO与水、氧气反应可生成硝酸;
③在饱和食盐水中通入氨气,形成饱和氨盐水,再向其中通入二氧化碳,可生成NaHCO3,加热NaHCO3分解生成碳酸钠;
④FeS2燃烧生成SO2.
解答 解:①氯化铝为共价化合物,熔融状态不导电,不能用于冶炼铝,应用氧化铝,故错误;
②氨气催化氧化生成NO,NO与水、氧气反应可生成硝酸,为工业制备硝酸的重要反应原理,故正确;
③在在饱和食盐水中通入氨气,形成饱和氨盐水,再向其中通入二氧化碳,在溶液中就有了大量的钠离子、铵根离子、氯离子和碳酸氢根离子,其中NaHCO3溶解度最小,析出NaHCO3,加热NaHCO3分解生成碳酸钠,故正确;
④FeS2燃烧生成SO2,不能生成SO3,故错误.
故选A.
点评 本题考查物质之间的转化,为高频考点,侧重考查学生的分析能力,明确元素化合物性质及其转化关系是解本题关键,注意物质性质特殊性质,知道金属的冶炼方法与金属活泼性的关系,题目难度不大.

练习册系列答案
 小题狂做系列答案
小题狂做系列答案
相关题目
7.下列离子方程式正确的是( )
| A. | 向饱和碳酸钠溶液中通入二氧化碳:CO32-+CO2+H2O═2HCO3- | |
| B. | 二氧化锰与浓盐酸反应:MnO2+4HCl(浓)═Mn2++2Cl2↑+2H2O | |
| C. | 亚硫酸氢钠溶液中加过量澄清石灰水:2HSO3-+Ca2++2OH-═CaSO3↓+2H2O+SO32- | |
| D. | 金属钠与硫酸铜溶液反应:2Na+2H2O+Cu2+$\frac{\underline{\;\;△\;\;}}{\;}$2Na++Cu(OH)2↓+H2↑ |
7.下列各组中的两物质相互反应时,若改变反应条件(温度、浓度、反应物用量比),化学反应并不改变的是( )
| A. | Na和O2 | B. | Fe和FeCl3 | C. | Fe和H2SO4 | D. | AlCl3和NaOH |
12.设NA为阿伏加德罗常数值,下列说法正确的是( )
| A. | 1 mol Cl2分别与足量的铁或氢氧化钠溶液反应,转移电子数均为2NA | |
| B. | 将NA个NH3分子溶于1 L水中得到1 mol•L-1的氨水 | |
| C. | 标准状况下,22.4 L氮气与22.4 L苯所含分子数均为 NA | |
| D. | 常温常压下,32gO2、O3的混合物含有2NA个氧原子 |


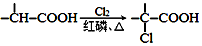

 +NaOH $→_{△}^{水}$
+NaOH $→_{△}^{水}$ +NaCl.
+NaCl. .
. 为原料制取
为原料制取  的合成路线图.合成路线图示例如下:
的合成路线图.合成路线图示例如下: +CH2═CH-M$→_{碱}^{Pb}$
+CH2═CH-M$→_{碱}^{Pb}$ =CH-M+HX(X为卤原子,M为烃基或含酯基的取代基等),由有机物A合成G(香豆素)的步骤如下:
=CH-M+HX(X为卤原子,M为烃基或含酯基的取代基等),由有机物A合成G(香豆素)的步骤如下: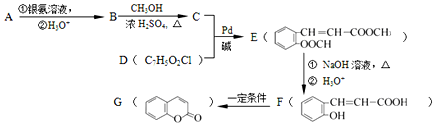
 .
. 中任意2种.
中任意2种. 的路线流程图:
的路线流程图: .
.