题目内容
在下列四种反应条件下,锌和硫酸反应产生H2速率最慢的是( )
| A、20℃时,将锌片放入0.01 mol/L的稀硫酸中 |
| B、20℃时,将锌片放入0.1 mol/L的稀硫酸中 |
| C、50℃时,将锌片放入0.01 mol/L的稀硫酸中 |
| D、50℃时,将锌片放入0.1 mol/L的稀硫酸中 |
考点:化学反应速率的影响因素
专题:化学反应速率专题
分析:根据温度越低、酸的浓度越小,则化学反应速率越慢,以此来解答.
解答:
解:根据选项温度,温度越低,反应速率越慢,所以A、B的速率慢于C、D,根据选项中,A项酸的浓度小,则化学反应速率越慢,所以A最慢.
故选A.
故选A.
点评:本题考查学生影响反应速率的因素:温度、浓度等,注意知识的归纳和整理以及应用是关键,难度不大.

练习册系列答案
 学练快车道快乐假期寒假作业系列答案
学练快车道快乐假期寒假作业系列答案 新思维寒假作业系列答案
新思维寒假作业系列答案
相关题目
X、Y、Z、W是原子序数依次增大的短周期主族元素,原子半径大小关系为:W>Y>Z>X.X与W同主族,Z原子核外电子总数是其内层电子总数的4倍,且Z原子的核电荷数等于X、Y原子核电荷数之和.下列说法正确的是( )
| A、元素Z、W的简单离子的半径:Z<W |
| B、元素Y、Z分别对应的简单气态氢化物M、N,沸点M<N,热稳定性M>N |
| C、仅由X、Y、Z三种元素形成的化合物的水溶液可能呈酸性,也可能呈碱性 |
| D、1mol X2Z2与1mol W2Z2所含共价键数目相等 |
分类法是人们认识事物时常用的科学方法.下列关于“Na2CO3”分类的说法错误的是( )
| A、属于钠盐 |
| B、属于电解质 |
| C、属于离子化合物 |
| D、属于氧化物 |
下列实验方案正确且能达到相应实验预期目的是( )
A、 配置一定物质的量浓度的硫酸溶液 |
B、 检验装置的气密性 |
C、 从碘水中分离碘单质 |
D、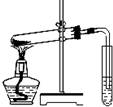 探究碳酸氢钠的热稳定性 |
据图判断下列说法正确的是( )


| A、图1中醋酸电离平衡常数:a点的比b点的小 |
| B、图1中醋酸溶液的pH:b点的比a点的大 |
| C、图2中c点对应的溶液为Fe(OH)3的不饱和溶液 |
| D、由图2可知,欲除去CuSO4溶液中的Fe3+,可向溶液中加入适量CuO,调pH约为4左右 |
室温下,向10mL,pH=12的某碱溶液中加入10mL pH=2的盐酸,充分反应后滴入酚酞试液,溶液变红,则此碱一定是( )
| A、弱碱 | B、一元强碱 |
| C、多元强碱 | D、任何强碱 |
在下列各组溶液中,离子一定能大量共存的是( )
| A、0.1 mol/L NaClO溶液:Fe2+、K+、I-、Cl- | ||
| B、通入足量CO2后的溶液中:Na+、C6H5O-、CH3COO-、HCO3- | ||
| C、加入铝粉能产生氢气的溶液中:NH4+、Fe2+、NO3-、SO42- | ||
D、
|