题目内容
A、B、C、D是四种短周期元素,它们的原子序数依次增大,其中A元素的原子只有一个电子层,又知A与C、B与D分别是同一主族的元素,B、D两元素的原子核中质子数之和是A、C两元素原子核中质子数之和的二倍,又知四种元素的单质常温常压下有两种气体、两种固体.请回答下列问题:
(1)D元素在周期表中的位置 ,由A、B两种元素可形成E、F两种化合物,写出其中一种化合物分解生成另一种化合物的化学方程式: ,反应物的电子式是 .其所含化学键为 .
a.离子键 b.极性共价键 c.非极性共价键
(2)B元素比D元素的非金属性强的依据是: .
①两元素组成的化合物中D元素为正价
②单质的熔沸点的高低
③最高价氧化物对应的水化物的酸性强弱
④气态氢化物的稳定性
(3)由A、B、D三种元素中的两种可分别形成甲、乙两种粒子,它们均为负一价双原子核的阴离子,且甲含有18个电子,乙含有10个电子,则甲与乙反应的离子方程式为: .
(4)写出C和D两元素的最高价氧化物对应的水化物在稀溶液里相互反应的热化学方程式(已知此反应生成1molH2O时放出的热量为57.3kJ): .
(5)用A元素的单质与B元素的单质可以制成电池,电池中装有KOH浓溶液,用多孔的金属惰性电极浸入KOH溶液,在M极通入A的单质,N极通入B的单质,则M极是该电池的 极;N极的电极反应式为: .
(1)D元素在周期表中的位置
a.离子键 b.极性共价键 c.非极性共价键
(2)B元素比D元素的非金属性强的依据是:
①两元素组成的化合物中D元素为正价
②单质的熔沸点的高低
③最高价氧化物对应的水化物的酸性强弱
④气态氢化物的稳定性
(3)由A、B、D三种元素中的两种可分别形成甲、乙两种粒子,它们均为负一价双原子核的阴离子,且甲含有18个电子,乙含有10个电子,则甲与乙反应的离子方程式为:
(4)写出C和D两元素的最高价氧化物对应的水化物在稀溶液里相互反应的热化学方程式(已知此反应生成1molH2O时放出的热量为57.3kJ):
(5)用A元素的单质与B元素的单质可以制成电池,电池中装有KOH浓溶液,用多孔的金属惰性电极浸入KOH溶液,在M极通入A的单质,N极通入B的单质,则M极是该电池的
考点:位置结构性质的相互关系应用,化学键
专题:元素周期律与元素周期表专题
分析:A、B、C、D是四种短周期元素,它们的原子序数依次增大,A元素的原子只有一个电子层,A与C同主族,则A为H元素;B与D同主族,分别处于二、三周期,二者质子数之和至少为11,两元素的原子核中质子数之和是A、C两元素原子核中质子数之和的二倍,C不可能为Li,可推知C为Na;则B、D质子数之和为(1+11)×2=24,令B的质子数为x、则D的质子数为x+8,则x+x+8=22,解得x=8,则B为O元素、D为S元素,符合四种元素的单质常温常压下有两种气体、两种固体,据此解答.
解答:
解:A、B、C、D是四种短周期元素,它们的原子序数依次增大,A元素的原子只有一个电子层,A与C同主族,则A为H元素;B与D同主族,分别处于二、三周期,二者质子数之和至少为11,两元素的原子核中质子数之和是A、C两元素原子核中质子数之和的二倍,C不可能为Li,可推知C为Na;则B、D质子数之和为(1+11)×2=24,令B的质子数为x、则D的质子数为x+8,则x+x+8=22,解得x=8,则B为O元素、D为S元素,符合四种元素的单质常温常压下有两种气体、两种固体,
(1)D为S元素,处于周期表中第三周期ⅥA族,由H、O两种元素可形成E、F两种化合物,其中一种化合物分解生成另一种化合物,应是H2O2分解生成H2O与O2,该反应方程式为:2H2O2
2H2O+O2↑,H2O2的电子式是 ,分子中H原子与O原子之间形成极性键,氧原子之间形成非极性键,
,分子中H原子与O原子之间形成极性键,氧原子之间形成非极性键,
故答案为:第三周期ⅥA族;2H2O2
2H2O+O2↑; ;bc;
;bc;
(2)①两元素组成的化合物中S元素为正价,说明O元素对键合电子吸引更强,O元素非金属性强,故①正确;
②单质的熔沸点属于物理性质,不能比较金属性强弱,故②错误;
③氧元素不存在最高价氧化物对应的水化物,故③错误;
④气态氢化物稳定,中心元素的非金属性越强,故④正确,
故答案为:①④;
(3)由H、O、S三种元素中的两种可分别形成甲、乙两种粒子,它们均为负一价双原子核的阴离子,且甲含有18个电子,乙含有10个电子,则甲为HS-、乙为OH-,则甲与乙反应的离子方程式为:HS-+OH-=S2-+H2O,
故答案为:HS-+OH-=S2-+H2O;
(4)氢氧化钠与稀硫酸反应生成硫酸钠与水,已知此反应生成1molH2O时放出的热量为57.3kJ,则该反应热化学方程式为:2NaOH(aq)+H2SO4(aq)=Na2SO4(aq)+2H2O(l)△H=-114.6kJ/mol,
故答案为:2NaOH(aq)+H2SO4(aq)=Na2SO4(aq)+2H2O(l)△H=-114.6kJ/mol;
(5)用氢气、氧气制成电池,电池中装有KOH浓溶液,用多孔的金属惰性电极浸入KOH溶液,在M极通入氢气的单质,N极通入氧气的单质,氢气发生氧化反应,则M极是该电池的负极;N极发生还原反应,氧气获得电子,碱性条件下生成氢氧根,电极反应式为:O2+2H2O+4e-=4OH-,
故答案为:负;O2+2H2O+4e-=4OH-.
(1)D为S元素,处于周期表中第三周期ⅥA族,由H、O两种元素可形成E、F两种化合物,其中一种化合物分解生成另一种化合物,应是H2O2分解生成H2O与O2,该反应方程式为:2H2O2
| ||
 ,分子中H原子与O原子之间形成极性键,氧原子之间形成非极性键,
,分子中H原子与O原子之间形成极性键,氧原子之间形成非极性键,故答案为:第三周期ⅥA族;2H2O2
| ||
 ;bc;
;bc;(2)①两元素组成的化合物中S元素为正价,说明O元素对键合电子吸引更强,O元素非金属性强,故①正确;
②单质的熔沸点属于物理性质,不能比较金属性强弱,故②错误;
③氧元素不存在最高价氧化物对应的水化物,故③错误;
④气态氢化物稳定,中心元素的非金属性越强,故④正确,
故答案为:①④;
(3)由H、O、S三种元素中的两种可分别形成甲、乙两种粒子,它们均为负一价双原子核的阴离子,且甲含有18个电子,乙含有10个电子,则甲为HS-、乙为OH-,则甲与乙反应的离子方程式为:HS-+OH-=S2-+H2O,
故答案为:HS-+OH-=S2-+H2O;
(4)氢氧化钠与稀硫酸反应生成硫酸钠与水,已知此反应生成1molH2O时放出的热量为57.3kJ,则该反应热化学方程式为:2NaOH(aq)+H2SO4(aq)=Na2SO4(aq)+2H2O(l)△H=-114.6kJ/mol,
故答案为:2NaOH(aq)+H2SO4(aq)=Na2SO4(aq)+2H2O(l)△H=-114.6kJ/mol;
(5)用氢气、氧气制成电池,电池中装有KOH浓溶液,用多孔的金属惰性电极浸入KOH溶液,在M极通入氢气的单质,N极通入氧气的单质,氢气发生氧化反应,则M极是该电池的负极;N极发生还原反应,氧气获得电子,碱性条件下生成氢氧根,电极反应式为:O2+2H2O+4e-=4OH-,
故答案为:负;O2+2H2O+4e-=4OH-.
点评:本题考查结构性质位置关系应用,涉及电子式、非金属性强弱比较、热化学方程式、原电池等,推断元素是解题关键,A为主族元素且有一个电子层为推断突破口,(2)中③为易错点,学生容易忽略氧元素没有含氧酸,难度中等.

练习册系列答案
 全优考典单元检测卷及归类总复习系列答案
全优考典单元检测卷及归类总复习系列答案 品学双优卷系列答案
品学双优卷系列答案 小学期末冲刺100分系列答案
小学期末冲刺100分系列答案
相关题目
下列叙述正确的是( )
| A、用电解法精炼粗铜时,粗铜做阴极 |
| B、铜-锌原电池工作时,负极从外电路得到电子 |
| C、用惰性电极电解饱和氯化钠溶液时,在标准状况下,两极产生的气体体积比为1:1 |
| D、用铂电极电解NaOH稀溶液一段时间后,溶液的质量分数不变 |
工业上利用铝粉除去含氮废水中的NO3-,当控制溶液pH=10.7左右时,所得产物中氮气和氨气的物质的量之比为4:1,则除去含0.1mol NO3-的废水所消耗铝粉的质量至少为( )
| A、3.53g |
| B、4.80g |
| C、5.04g |
| D、8.64g |
在下列四种反应条件下,锌和硫酸反应产生H2速率最慢的是( )
| A、20℃时,将锌片放入0.01 mol/L的稀硫酸中 |
| B、20℃时,将锌片放入0.1 mol/L的稀硫酸中 |
| C、50℃时,将锌片放入0.01 mol/L的稀硫酸中 |
| D、50℃时,将锌片放入0.1 mol/L的稀硫酸中 |

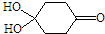 )分子间脱水而得;一定条件下,M发生1个-OH的消去反应得到稳定化合物N(分子式为C6H8O2),则N的结构简式为
)分子间脱水而得;一定条件下,M发生1个-OH的消去反应得到稳定化合物N(分子式为C6H8O2),则N的结构简式为
 ).
). )发生类似反应①的反应,其生成物的结构简式为
)发生类似反应①的反应,其生成物的结构简式为
 (1)过渡金属元素铁能形成多种配合物,如:[Fe(H2NCONH2)6](NO3)3[三硝酸六尿素合铁(Ⅲ)]和Fe(CO)x等.
(1)过渡金属元素铁能形成多种配合物,如:[Fe(H2NCONH2)6](NO3)3[三硝酸六尿素合铁(Ⅲ)]和Fe(CO)x等.