题目内容
 钠钾是活泼的碱金属,过氧化钠(Na2O2)、过氧化钾(K2O2)和超氧化钾(KO2) 在医院、矿井、潜水、高空飞行中用作供氧剂.某航天飞行器座舱内空气更新过程如图所示:
钠钾是活泼的碱金属,过氧化钠(Na2O2)、过氧化钾(K2O2)和超氧化钾(KO2) 在医院、矿井、潜水、高空飞行中用作供氧剂.某航天飞行器座舱内空气更新过程如图所示:(1)请写出过氧化钠的电子式
(2)图Ⅱ是CO2和H2的反应装置,该反应的化学方程式
(3)从装置Ⅰ,Ⅱ,Ⅲ可看出,O2的来源是CO2和H2O,宇航员每天消耗28mol O2,呼出23mol CO2,则宇航员每天呼出的气体中含H2O
(4)超氧化钾和二氧化碳反应生成氧气,13.2L(标准状况)CO2和KO2反应后,气体体积变为18.8L (标准状况),计算反应消耗的KO2的质量为
考点:碱金属的性质,钠的化学性质
专题:金属概论与碱元素
分析:(1)过氧化钠是离子化合物,由钠离子与过氧根离子构成,过氧根中两个氧原子通过共用电子对结合;
(2)从图中转化关系可知,CO2和H2的反应生成碳和水,据此写出方程式;
(3)根据氧原子守恒可知2n(O2)=2n(CO2)+n(H2O),据此解答;
(4)依据反应:4KO2+2CO2═2K2CO3+3O2,依据气体差量计算.
(2)从图中转化关系可知,CO2和H2的反应生成碳和水,据此写出方程式;
(3)根据氧原子守恒可知2n(O2)=2n(CO2)+n(H2O),据此解答;
(4)依据反应:4KO2+2CO2═2K2CO3+3O2,依据气体差量计算.
解答:
解:(1)过氧化钠是离子化合物,由钠离子与过氧根离子构成,过氧根中两个氧原子通过共用电子对形成共价键,电子式为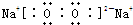 ,含有离子键和共价键;
,含有离子键和共价键;
故答案为: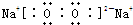 ;离子键和共价键;
;离子键和共价键;
(2)CO2和H2的反应生成碳和水,化学方程式为:CO2+H2=C+2H2O;
故答案为:CO2+H2=C+2H2O;
(3)O2的来源是CO2和H2O,根据氧原子守恒可知2n(O2)=2n(CO2)+n(H2O),即28mol×2=2×23mol+n(H2O),解得n(H2O)=10mol,
故答案为:10;
(4)依据超氧化钾和二氧化碳反应可知:
4KO2 +2CO2═2K2CO3+3O2 △V
4×71g 2mol 3 mol 1mol
m
解得m=71g;
故答案为:71.
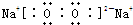 ,含有离子键和共价键;
,含有离子键和共价键;故答案为:
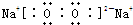 ;离子键和共价键;
;离子键和共价键;(2)CO2和H2的反应生成碳和水,化学方程式为:CO2+H2=C+2H2O;
故答案为:CO2+H2=C+2H2O;
(3)O2的来源是CO2和H2O,根据氧原子守恒可知2n(O2)=2n(CO2)+n(H2O),即28mol×2=2×23mol+n(H2O),解得n(H2O)=10mol,
故答案为:10;
(4)依据超氧化钾和二氧化碳反应可知:
4KO2 +2CO2═2K2CO3+3O2 △V
4×71g 2mol 3 mol 1mol
m
| (18.8-13.2)L |
| 22.4L/mol |
解得m=71g;
故答案为:71.
点评:本题为信息题,明确图中转化关系,熟悉过氧化钠结构及性质是解题关键,侧重培养学生综合分析问题、对已有知识迁移应用的能力.

练习册系列答案
 轻松暑假总复习系列答案
轻松暑假总复习系列答案
相关题目
蛋白质是人体必需的重要营养成分之一.下列食物中,富含蛋白质的是( )
| A、豆油 | B、馒头 | C、西红柿 | D、豆腐 |
w g含有双键的不饱和烃X能与VL的氢气(标准状况)完全反应,若X的相对分子质量为M,阿伏加德罗常数为NA,则1mol X中含有双键数目为( )
A、
| ||
B、
| ||
C、
| ||
D、
|
下列各组物质中,属于醇类但不是同系物的是( )
| A、CH3OH和CH3CH2CH2OH |
| B、CH3COOH和C6H5CH2OH |
| C、CH3CH2OH和CH2=CHCH2OH |
| D、C6H5OH和C6H5CH2OH |
已知可用Co2O3代替MnO2制备Cl2,反应前后存在六种微粒:Co2O3、H2O、Cl2、H+、Cl-和Co2+.下列叙述不正确的是( )
| A、氧化产物为Cl2 |
| B、若有3molH2O生成,则反应中有2mol电子转移 |
| C、微粒的还原性Cl->Co2+ |
| D、氧化剂与还原剂的物质的量之比为1:6 |
下表中元素均为中学化学中常见短周期元素,根据表中信息,下列说法不正确的是( )
| 元素代号 | X | Y | Z | W | N |
| 原子半径/nm | 0.186 | 0.074 | 0.102 | 0.099 | 0.160 |
| 主要化合价 | +1 | -2 | -2、+6 | +7、-1 | +2 |
| A、X的最高价氧化物对应水化物的碱性比N的强 |
| B、由X、Y、Z三种元素只能组成一种含有离子键和共价键的化合物 |
| C、化台物X2Z的晶体类型与NW2的晶体类型相同 |
| D、由X和Y形成的一种淡黄色固体化合物中阴、阳离子个数比为1:2 |
将8克SO3加入X克水中,所形成的溶液里SO42-和水分子个数比为1:5,则X等于( )
| A、9克 | B、10.8克 |
| C、12.4克 | D、15.6克 |
分类在科学研究中必须用的方法,下列关于化学的分类说法正确的是( )
| A、干冰、HD均为化合物;水玻璃、水银均为混合物;纯碱和生石灰分别属于碱和氧化物;蔗糖、PVC、淀粉都是高分子化合物 |
| B、根据一个酸分子电离产生氢离子的个数将酸分为一元酸、二元酸等 |
| C、由于饱和碳酸钙的导电性比饱和氨水的导电性弱,所以碳酸钙是弱电解质 |
| D、根据元素原子最外层电子数的多少将元素分为金属元素和非金属元素 |
 (1)设计的原电池如图1所示,回答下列问题:
(1)设计的原电池如图1所示,回答下列问题: