题目内容
在标准状况下,向1L水中通入VL NH3,NH3完全溶解形成氨水的密度为d g?cm-3,则氨水的物质的量浓度是( )
A、
| ||
B、
| ||
C、
| ||
D、
|
考点:物质的量浓度的相关计算
专题:
分析:根据n=
计算出氨气的物质的量,再根据m=nM计算出氨气的质量,然后利用溶液质量=溶剂质量+溶质质量计算出溶液质量,根据V=
求出溶液的体积,最后利用c=
计算溶液的物质的量浓度.
| V |
| Vm |
| m |
| ρ |
| n |
| V |
解答:
解:1L水的质量为:1000mL×1g/mol=1000g,
标准状况下VL氨气的质量为:m(NH3)=17g/mol×
=
g,
溶液的质量为:1000g+
g=(1000+
)g,
溶液的体积为:V=
=
L,
形成的溶液的物质的量浓度为:c=
=
mol/L,
故选D.
标准状况下VL氨气的质量为:m(NH3)=17g/mol×
| VL |
| 22.4L/mol |
| 17V |
| 22.4 |
溶液的质量为:1000g+
| 17V |
| 22.4 |
| 17V |
| 22.4 |
溶液的体积为:V=
(1000+
| ||
| 1000d/L |
| 22400+17V |
| 22400d |
形成的溶液的物质的量浓度为:c=
| ||
|
| 1000Vd |
| 22400+17V |
故选D.
点评:本题考查物质的量浓度有关计算,属于字母型计算,容易出错,注意掌握物质的量浓度的概念,明确物质的量浓度与溶质质量分数的关系,试题有利于培养学生的分析、理解能力及化学计算能力.

练习册系列答案
相关题目
下列措施或事实不能用勒夏特列原理解释的是( )
| A、新制的氯水在光照下颜色变浅 |
| B、合成NH3反应,为提高NH3的产率,理论上应采取相对较低温度的措施 |
| C、向稀盐酸中加入少量蒸馏水,盐酸中氢离子浓度降低 |
| D、实验室中常用排饱和食盐水的方式收集氯气 |
下列对化学反应速率的认识正确的是( )
| A、H+和OH-的反应活化能接近于零,反应几乎在瞬间完成 |
| B、对于任何化学反应来说,反应速率越大,反应现象就越明显 |
| C、选用适当的催化剂,分子运动加快,增加了碰撞频率,故反应速率增大 |
| D、化学反应速率是指一定时间内任何一种反应物浓度的减少或任何一种生成物浓度的增加 |
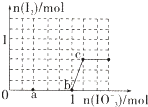 已知含3molNaHSO3的溶液中逐滴加入KIO3溶液,加入的KIO3和析出的I2的物质的量的关系曲线如图所示,则下列判断不正确的是( )
已知含3molNaHSO3的溶液中逐滴加入KIO3溶液,加入的KIO3和析出的I2的物质的量的关系曲线如图所示,则下列判断不正确的是( )| A、还原性:HSO3->I-,氧化性:IO3->I2>SO42- |
| B、a点处的氧化产物是SO42-,还原产物是I- |
| C、当溶液中的I-为0.4mol时,加入的KIO3一定为0.4mol |
| D、若向KIO3溶液中滴加NaHSO3溶液,反应开始时的离子方程式为:2IO3-+5HSO3-=I2,+5SO42-+3H++H2O |
3NO2十H2O═2HNO3十NO为工业上氨催化氧化法制硝酸的反应之一,该反应中NO2的作用是( )
| A、只作氧化剂 |
| B、作催化剂 |
| C、既作氧化剂又作还原剂 |
| D、作干燥剂 |
下列说法正确的是( )
| A、两种原子形成的共价键一定是极性共价键 |
| B、元素金属性越强,对应单质的还原性越强;元素非金属性越强,对应单质的氧化性越强 |
| C、由金属元素和非金属元素组成的化合物一定是离子化合物 |
| D、按照元素周期表的排布规律,非金属元素最多有23种 |
同温同压下,等质量的O2和O3,对于二者的说法错误的是( )
| A、物质的量之比3:2 |
| B、原子数之比为1:1 |
| C、体积之比为 2:3 |
| D、质子数之比1:1 |
在标准状况下,将X气体VL溶于水中,得到2mol/L的溶液500mL,则气体的体积V为( )
| A、44.8L |
| B、22.4L |
| C、11.2L |
| D、33.6L |
 如图是给病人输液用的氯化钠注射溶液的标签.(友情提示:若要用到溶液密度,可用水的密度进行计算)
如图是给病人输液用的氯化钠注射溶液的标签.(友情提示:若要用到溶液密度,可用水的密度进行计算)