题目内容
15.下列只用试管和滴管就能鉴别开的一组溶液是( )| A. | BaCl2和H2SO4 | B. | AlCl3和NH3•H2O | C. | NaCl和AgNO3 | D. | Al2(SO4)3和NaOH |
分析 只用试管和胶头滴管就可以对下列各组中的两种溶液进行鉴别,则物质之间添加顺序不同,发生反应产生的现象不同,以此来解答.
解答 解:A.二者反应与量无关,改变滴定顺序均生成硫酸钡白色沉淀,不能鉴别,故A不选;
B.二者反应与量无关,改变滴定顺序均生成氢氧化铝白色沉淀,不能鉴别,故B不选;
C.二者反应与量无关,改变滴定顺序均生成AgCl白色沉淀,不能鉴别,故C不选;
D.NaOH少量时生成白色沉淀,NaOH过量时沉淀消失,反应与量有关,则只用试管和滴管就能鉴别Al2(SO4)3和NaOH,故D选;
故选D.
点评 本题考查物质的鉴别和检验,为高频考点,把握物质的性质、发生的反应及现象为解答的关键,侧重分析与应用能力的考查,注意与量有关的反应,题目难度不大.

练习册系列答案
相关题目
6.某化学兴趣小组在探究铝的性质时,发现铝片(没有除去氧化膜)与pH相同(pH=1)的盐酸和硫酸在同温同压下反应时两者产生气体的速率盐酸明显比硫酸快,其可能的原因是( )
| A. | 上述两溶液中盐酸的物质的量浓度比硫酸的物质的量浓度大 | |
| B. | 硫酸使铝钝化 | |
| C. | 生成的氯化铝能溶于水,而生成的硫酸铝难溶于水 | |
| D. | 氯离子可能破坏氧化铝薄膜,而硫酸根离子不能 |
3.下列混合物可以用分液漏斗分离的是( )
| A. | 溴乙烷和水 | B. | 乙醇和乙酸 | C. | 甘油和水 | D. | 溴苯和苯 |
10.明矾[KAl(SO4)2•12H2O]在生产、生活中有广泛用途:饮用水的净化、食品工业的发酵剂等.利用炼铝厂的废料--铝灰(含Al、Al2O3及少量SiO2和FeO•xFe2O3)可制备明矾.工艺流程如下:
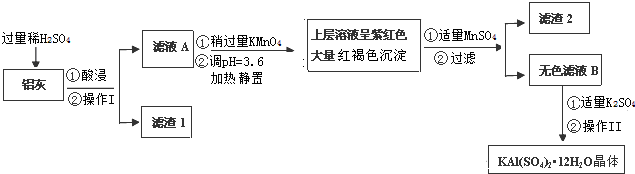
回答下列问题:
(1)明矾净水的原理是(用离子方程表示):Al3++3H2O?Al(OH)3+3H+;
(2)操作Ⅱ是:蒸发浓缩,冷却结晶、过滤、洗涤、干燥.
(3)检验滤液A中是否存在Fe2+的试剂是②(只用一种试剂,填序号)
①KSCN溶液; ②KMnO4酸性溶液; ③KI淀粉溶液.
(4)在滤液A中加入高锰酸钾发生反应的离子方程式为(该条件下Fe2+ 转化为Fe3+,MnO4-转化为Mn2+)5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O.
已知:生成氢氧化物沉淀的pH如下表所示
注:金属离子的起始浓度为0.1mol•L-1根据表中数据解释调pH=3.6的目的使Fe3+转化成Fe(OH)3沉淀,并防止Al3+沉淀.
(5)己知:在pH=3、加热条件下,MnO4-可与Mn2+反应生成MnO2.
加入MnSO4发生反应的离子方程式为:3Mn2++2MnO4-+2H2O=5MnO2+4H+.滤渣2含有的物质是MnO2、Fe(OH)3.

回答下列问题:
(1)明矾净水的原理是(用离子方程表示):Al3++3H2O?Al(OH)3+3H+;
(2)操作Ⅱ是:蒸发浓缩,冷却结晶、过滤、洗涤、干燥.
(3)检验滤液A中是否存在Fe2+的试剂是②(只用一种试剂,填序号)
①KSCN溶液; ②KMnO4酸性溶液; ③KI淀粉溶液.
(4)在滤液A中加入高锰酸钾发生反应的离子方程式为(该条件下Fe2+ 转化为Fe3+,MnO4-转化为Mn2+)5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O.
已知:生成氢氧化物沉淀的pH如下表所示
| Al(OH)3 | Fe(OH)2 | Fe(OH)3 | |
| 开始沉淀时 | 3.8 | 7.5 | 2.7 |
| 完全沉淀时 | 5.2 | 9.7 | 3.2 |
(5)己知:在pH=3、加热条件下,MnO4-可与Mn2+反应生成MnO2.
加入MnSO4发生反应的离子方程式为:3Mn2++2MnO4-+2H2O=5MnO2+4H+.滤渣2含有的物质是MnO2、Fe(OH)3.
7.能够说明硫的非金属性比氯弱的事实有( )
①Cl2与铁反应生成FeCl3,S与铁反应生成FeS;
②Cl2和H2的混合气,经强光照射可剧烈反应,而S与H2反应需较高温度;
③将Cl2通入氢硫酸中可置换出硫;
④常温时硫单质为固态而氯单质为气态.
①Cl2与铁反应生成FeCl3,S与铁反应生成FeS;
②Cl2和H2的混合气,经强光照射可剧烈反应,而S与H2反应需较高温度;
③将Cl2通入氢硫酸中可置换出硫;
④常温时硫单质为固态而氯单质为气态.
| A. | ①③ | B. | ①②③④ | C. | ②④ | D. | ①②③ |
4.下列变化规律正确的是( )
| A. | Na、Mg、Al的还原性依次增强 | B. | HF、HCl、H2S的稳定性依次增强 | ||
| C. | H、Li、Na的原子半径依次增大 | D. | KOH、Mg(OH)2、Al(OH)3的碱依次增强 |
 E、
E、