题目内容
化学在能源开发与利用中起着十分重要的作用.
(l)蕴藏在海底的可燃冰是高压下形成的外观像冰的甲烷水合物固体.被称之为“未来能源”.在25℃、101kPa下,1g甲烷完全燃烧生成和液态水时放热55.6kJ.甲烷燃烧的热化学方程式为 :相同条件下,356g可燃冰(分子式为CH4?9H2O,Mr=178)释放的甲烷气体完全燃烧生成CO2和液态水,放出的热量为 kJ.
(2)二甲醚(CH3OCH3)是无色气体,可作为一种新型能源,具有清洁、高效的优良性能.由合成气(组成为H2、CO和少量的CO2)直接制各二甲醚,其中的主要过程包括以下四个反应:
甲醇合成反应:(i)CO(g)+2H2(g)═CH3OH(g)△H1=-90.1kJ?mol-1
(ii)CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H2=-49.0kJ?mol-1
水煤气变换反应:(iii)CO(g)+H2O(g)═CO2(g)+H2(g)△H3=-41.1kJ?mol-1
二甲醚合成反应:(iv)2CH3OH(g)═CH3OCH3(g)+H2O(g)△H4=-24.5kJ?mol-1
①分析二甲醚合成反应(iv)对于CO转化率的影响 .
②由H2和CO直接制备二甲醚(另一产物为水蒸气)的热化学方程式为: .根据化学反应原理,分析增加压强对直接制备二甲醚反应的影响 .
(3)二甲醚直接燃料电池具有启动快、效率高等优点.若电解质为碱性,二甲醚直接燃料电池的负极反应为 ,一个二甲醚分子经过电化学氧化,可以产生 电子的电量.51.
(l)蕴藏在海底的可燃冰是高压下形成的外观像冰的甲烷水合物固体.被称之为“未来能源”.在25℃、101kPa下,1g甲烷完全燃烧生成和液态水时放热55.6kJ.甲烷燃烧的热化学方程式为
(2)二甲醚(CH3OCH3)是无色气体,可作为一种新型能源,具有清洁、高效的优良性能.由合成气(组成为H2、CO和少量的CO2)直接制各二甲醚,其中的主要过程包括以下四个反应:
甲醇合成反应:(i)CO(g)+2H2(g)═CH3OH(g)△H1=-90.1kJ?mol-1
(ii)CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H2=-49.0kJ?mol-1
水煤气变换反应:(iii)CO(g)+H2O(g)═CO2(g)+H2(g)△H3=-41.1kJ?mol-1
二甲醚合成反应:(iv)2CH3OH(g)═CH3OCH3(g)+H2O(g)△H4=-24.5kJ?mol-1
①分析二甲醚合成反应(iv)对于CO转化率的影响
②由H2和CO直接制备二甲醚(另一产物为水蒸气)的热化学方程式为:
(3)二甲醚直接燃料电池具有启动快、效率高等优点.若电解质为碱性,二甲醚直接燃料电池的负极反应为
考点:热化学方程式,常见化学电源的种类及其工作原理,化学平衡的影响因素
专题:
分析:(1)依据热化学方程式书写方法,标注物质聚集状态和对应反应焓变写出热化学方程式;356 g CH4?9H2O可以释放出2 mol CH4,再根据燃烧热的计算;
(2)①二甲醚合成反应(Ⅳ)对于CO转化率的影响,结合甲醇合成反应,水煤气变换反应和化学平衡移动原理分析判断;
②依据热化学方程式和盖斯定律计算得到,依据计算得到的反应结合化学平衡移动原理分析判断增大压强的影响;
(3)燃料电池中燃料在负极上失电子发生氧化反应,正极发生还原反应,书写电极反应;书写电极反应,计算电子转移;
(2)①二甲醚合成反应(Ⅳ)对于CO转化率的影响,结合甲醇合成反应,水煤气变换反应和化学平衡移动原理分析判断;
②依据热化学方程式和盖斯定律计算得到,依据计算得到的反应结合化学平衡移动原理分析判断增大压强的影响;
(3)燃料电池中燃料在负极上失电子发生氧化反应,正极发生还原反应,书写电极反应;书写电极反应,计算电子转移;
解答:
解:(1)在25℃、101kPa下,1g甲烷完全燃烧生成和液态水时放热55.6kJ,1mol甲烷燃烧生成和液态水时放热889.6KJ,热化学方程式为:CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-889.6KJ/mol;356 g CH4?9H2O可以释放出2 mol CH4,已知甲烷的燃烧热为889.6 kJ/mol,则889.6kJ/mol×2 mol=1779.2kJ;
故答案为:CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-889.6KJ/mol,1779.2;
(2)①二甲醚合成反应(Ⅳ)对于CO转化率的影响,消耗甲醇,促进甲醇合成反应(Ⅰ)CO(g)+2H2(g)═CH3OH(g)平衡右移,CO转化率增大;生成的H2O,通过水煤气变换反应(Ⅲ)CO(g)+H2O(g)═CO2(g)+H2 (g)消耗部分CO,
故答案为:消耗甲醇,促进甲醇合成反应(Ⅰ)平衡右移,CO转化率增大;生成的H2O,通过水煤气变换反应(Ⅲ)消耗部分CO;
②Ⅰ、CO(g)+2H2(g)═CH3OH(g)△H1=-90.1kJ?mol-1
Ⅳ、2CH3OH(g)═CH3OCH3(g)+H2O(g)△H4=-24.5kJ?mol-1
依据盖斯定律Ⅰ×2+Ⅳ得到:2CO(g)+4H2(g)=CH3OCH3+H2O(g)△H=-204.7kJ?mol-1
该反应是气体体积减小的反应,增加压强平衡正向进行,反应速率增大,CO和H2转化率增大,CH3OCH3产率增加,
故答案为:2CO(g)+4H2(g)=CH3OCH3(g)+H2O(g)△H=-204.7kJ?mol-1;该反应分子数减少,压强升高使平衡右移,CO和H2转化率增大,CH3OCH3产率增加.压强升高使CO和H2浓度增加,反应速率增大;
(3)若电解质为碱性,氧气在正极发生还原反应,O2+2H2O+4e-=4OH-,二甲醚直接燃料电池的负极反应为二甲醚失电子生成二氧化碳,碱溶液中生成碳酸盐,结合原子守恒和电荷守恒写出电极反应为:CH3OCH3+16OH--12e-=2CO32-+11H2O,二甲醚直接燃料电池的负极反应为二甲醚失电子生成二氧化碳,一个二甲醚分子经过电化学氧化失去12个电子,
故答案为:CH3OCH3+16OH--12e-=2CO32-+11H2O,12;
故答案为:CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-889.6KJ/mol,1779.2;
(2)①二甲醚合成反应(Ⅳ)对于CO转化率的影响,消耗甲醇,促进甲醇合成反应(Ⅰ)CO(g)+2H2(g)═CH3OH(g)平衡右移,CO转化率增大;生成的H2O,通过水煤气变换反应(Ⅲ)CO(g)+H2O(g)═CO2(g)+H2 (g)消耗部分CO,
故答案为:消耗甲醇,促进甲醇合成反应(Ⅰ)平衡右移,CO转化率增大;生成的H2O,通过水煤气变换反应(Ⅲ)消耗部分CO;
②Ⅰ、CO(g)+2H2(g)═CH3OH(g)△H1=-90.1kJ?mol-1
Ⅳ、2CH3OH(g)═CH3OCH3(g)+H2O(g)△H4=-24.5kJ?mol-1
依据盖斯定律Ⅰ×2+Ⅳ得到:2CO(g)+4H2(g)=CH3OCH3+H2O(g)△H=-204.7kJ?mol-1
该反应是气体体积减小的反应,增加压强平衡正向进行,反应速率增大,CO和H2转化率增大,CH3OCH3产率增加,
故答案为:2CO(g)+4H2(g)=CH3OCH3(g)+H2O(g)△H=-204.7kJ?mol-1;该反应分子数减少,压强升高使平衡右移,CO和H2转化率增大,CH3OCH3产率增加.压强升高使CO和H2浓度增加,反应速率增大;
(3)若电解质为碱性,氧气在正极发生还原反应,O2+2H2O+4e-=4OH-,二甲醚直接燃料电池的负极反应为二甲醚失电子生成二氧化碳,碱溶液中生成碳酸盐,结合原子守恒和电荷守恒写出电极反应为:CH3OCH3+16OH--12e-=2CO32-+11H2O,二甲醚直接燃料电池的负极反应为二甲醚失电子生成二氧化碳,一个二甲醚分子经过电化学氧化失去12个电子,
故答案为:CH3OCH3+16OH--12e-=2CO32-+11H2O,12;
点评:本题考查了热化学方程式和盖斯定律的应用,化学平衡移动原理的分析判断,原电池原理分析和电极书写,掌握基础是关键,题目难度中等.

练习册系列答案
 全优点练单元计划系列答案
全优点练单元计划系列答案
相关题目
下列关于葡萄糖的叙述,错误的是( )
| A、是白色晶体,能溶于水,有甜味 |
| B、是一种多羟基醛,有还原性 |
| C、能发生水解反应,生成酒精 |
| D、与果糖互为同分异构体 |
 麻黄素又称黄碱,是我国特定的中药材麻黄中所含的一种生物碱.经我国科学工作者研究发现其结构如图:
麻黄素又称黄碱,是我国特定的中药材麻黄中所含的一种生物碱.经我国科学工作者研究发现其结构如图: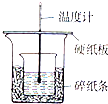 实验室利用如图装置进行中和热的测定,请回答下列问题:
实验室利用如图装置进行中和热的测定,请回答下列问题: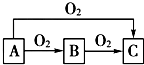 A、B、C是中学化学中常见的三种物质,它们之间的相互转化关系如图(部分反应条 件及产物略去):
A、B、C是中学化学中常见的三种物质,它们之间的相互转化关系如图(部分反应条 件及产物略去):