题目内容
11.某由C、H、O元素组成的有机物球棍结构模型如图所示,下列说法中不正确的是( )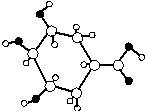
| A. | 该有机物不含苯环 | |
| B. | 分子式为C7H12O4 | |
| C. | 能与NaHCO3溶液反应生成CO2 | |
| D. | 1mol该有机物与足量的金属钠反应产生2molH2 |
分析 由结构可知环状结构中含2个CH2,不含苯环,含-OH、-COOH,结合醇、羧酸的性质来解答.
解答 解:A.由结构可知不含苯环,故A正确;
B.分子式为C7H12O5,故B错误;
C.含-COOH,能与NaHCO3溶液反应生成CO2,故C正确;
D.3个-OH、1个-COOH均与Na反应,则1mol该有机物与足量的金属钠反应产生2molH2,故D正确;
故选B.
点评 本题考查有机物的结构与性质,为高频考点,把握有机物的结构、官能团与性质的关系为解答的关键,侧重醇、羧酸的性质及分析与应用能力的考查,题目难度不大.

练习册系列答案
 探究与巩固河南科学技术出版社系列答案
探究与巩固河南科学技术出版社系列答案
相关题目
1.下列各组物质中,只用一种试剂不能鉴别的是( )
| A. | 苯酚溶液、乙醇、己烯、四氯化碳 | B. | 甲酸、乙酸、乙醛、乙醇 | ||
| C. | 淀粉溶液、乙醇、苯、四氯化碳 | D. | 苯、甲苯、己烯、溴苯 |
19.下列电子式书写正确的是( )
| A. | 氨气  | B. | 四氯化碳  | C. | 氮气  | D. | 过氧化氢  |
6.短周期元素A、B、C在元素周期表中所处的位置如表所示.A、B、C三种元素原子的质子数之和为32,D元素原子的最外层电子数为次外层电子数的2倍.则下列说法正确的是( )
| A | C | |
| B |
| A. | A、B、C三元素的气态氢化物溶于水均显酸性 | |
| B. | A、B两种元素的气态氢化物均能与它们的最高价氧化物对应的水化物发生反应,且反应类型相同 | |
| C. | C在周期表中的位置为第二周期第ⅦA族,最高价为+7价 | |
| D. | B02是酸性氧化物,AO2不是酸性氧化物 |
3.利用下列反应不能制得括号中纯净物质的是( )
| A. | 等物质的量的氯气与乙烷在光照条件下反应(氯乙烷) | |
| B. | 乙烯与氯气反应(1,2-二氯乙烷) | |
| C. | 液溴与苯用溴化铁作催化剂反应(溴苯) | |
| D. | 乙烯与水反应(乙醇) |
20.图1是碳的正常循环,但由于过度燃烧化石燃料,造成二氧化碳浓度不断上升.研究和解决二氧化碳捕集、存储和转化问题成为当前化学工作者的重要使命.
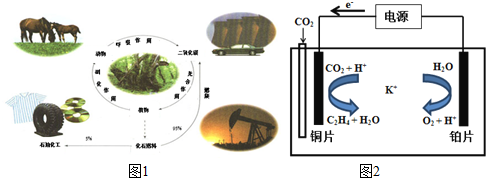
(1)有关碳循环的说法中正确的是ac
a.光合作用是光能转化成化学能
b.化石燃料是可再生的
c.循环过程有氧化还原反应
d.石油中含乙烯、丙烯,通过加聚反应得到高分子化合物
(2)用钌的配合物作催化剂,一定条件下可直接光催化分解CO2发生反应:2CO2(g)═2CO(g)+O2(g),该反应的△H>0,(选填:>、<、=).
(3)CO2转化途径之一是:利用太阳能或生物质能分解水制H2,然后将H2与CO2转化为甲醇或其它的物质.
2H2O(1)═2H2(g)+O2(g)△H=+571.5kJ•mol-1
3H2(g)+CO2(g)═CH3OH(l)+H2O(1)△H=-137.8kJ•mol-1
则反应:4H2O (1)+2CO2(g)═2CH3OH(l)+3O2(g)△H=+1438.9kJ•mol-1.
你认为该方法需要解决的技术问题有:ab.
a.开发高效光催化剂
b.将光催化制取的氢气从反应体系中有效分离,并与CO2催化转化.
c.二氧化碳及水资源的来源供应
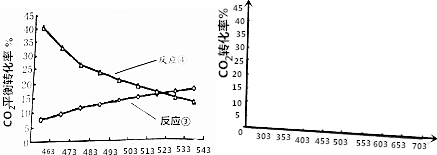
(4)用稀氨水喷雾捕集CO2最终可得产品NH4HCO3.在捕集时,气相中有中间体 NH2COONH4(氨基甲酸铵)生成.现将一定量纯净的氨基甲酸铵置于恒容的密闭真空容器中,分别在不同温度下进行反应:NH2COONH4(s)?2NH3(g)+CO2(g).实验测得的有关数据见下表.( t1<t2<t3)
氨基甲酸铵分解反应是吸热 反应(“放热”、“吸热”).在15℃,此反应的化学平衡常数为:4×10-6.
(5)用一种钾盐水溶液作电解质,CO2电催化还原为碳氢化合物(其原理见图).在阴极上产生乙烯的电极反应方程式为:2CO2+12H++12e-=CH2=CH2+4H2O.

(1)有关碳循环的说法中正确的是ac
a.光合作用是光能转化成化学能
b.化石燃料是可再生的
c.循环过程有氧化还原反应
d.石油中含乙烯、丙烯,通过加聚反应得到高分子化合物
(2)用钌的配合物作催化剂,一定条件下可直接光催化分解CO2发生反应:2CO2(g)═2CO(g)+O2(g),该反应的△H>0,(选填:>、<、=).
(3)CO2转化途径之一是:利用太阳能或生物质能分解水制H2,然后将H2与CO2转化为甲醇或其它的物质.
2H2O(1)═2H2(g)+O2(g)△H=+571.5kJ•mol-1
3H2(g)+CO2(g)═CH3OH(l)+H2O(1)△H=-137.8kJ•mol-1
则反应:4H2O (1)+2CO2(g)═2CH3OH(l)+3O2(g)△H=+1438.9kJ•mol-1.
你认为该方法需要解决的技术问题有:ab.
a.开发高效光催化剂
b.将光催化制取的氢气从反应体系中有效分离,并与CO2催化转化.
c.二氧化碳及水资源的来源供应
(4)用稀氨水喷雾捕集CO2最终可得产品NH4HCO3.在捕集时,气相中有中间体 NH2COONH4(氨基甲酸铵)生成.现将一定量纯净的氨基甲酸铵置于恒容的密闭真空容器中,分别在不同温度下进行反应:NH2COONH4(s)?2NH3(g)+CO2(g).实验测得的有关数据见下表.( t1<t2<t3)
温度(℃) 气体总浓度 (mol/L) 时间(min) | 15 | 25 | 35 |
| 0 | 0 | 0 | 0 |
| t1 | 9×10-3 | 2.7×10-2 | 8.1×10-2 |
| t2 | 3×10-2 | 4.8×10-2 | 9.4×10-2 |
| t3 | 3×10-2 | 4.8×10-2 | 9.4×10-2 |
(5)用一种钾盐水溶液作电解质,CO2电催化还原为碳氢化合物(其原理见图).在阴极上产生乙烯的电极反应方程式为:2CO2+12H++12e-=CH2=CH2+4H2O.
1.把0.1mol MgCl2固体溶于水配成100mL溶液,此溶液中Cl-的物质的量浓度为( )
| A. | 3.Omol•L-1 | B. | 2.Omol•L-1 | C. | O.3mol•L-1 | D. | O.2mol•L-1 |
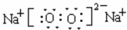 ,ED4的电子式是
,ED4的电子式是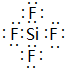 ;
;