题目内容
海洋中有丰富的食品、矿产、能源、药物和水产资源,如图为海水利用的部分过程.下列有关说法不正确的是( )


| A、工业上通过电解熔融状态MgCl2制取金属镁 |
| B、用澄清的石灰水可鉴别NaHCO3和Na2CO3 |
| C、在第②、④步骤中,溴元素均被氧化 |
| D、制取NaHCO3的反应是利用其溶解度小于NaCl |
考点:海水资源及其综合利用
专题:化学应用
分析:A、工业上是电解熔融的氯化镁来制取金属镁;
B、碳酸钠和碳酸氢钠和氢氧化钙之间均能反应,都会出现白色沉淀;
C、化合价升高的元素在反应中做还原剂被氧化;
D、在混合溶液中,溶解度小的物质会先结晶析出;
B、碳酸钠和碳酸氢钠和氢氧化钙之间均能反应,都会出现白色沉淀;
C、化合价升高的元素在反应中做还原剂被氧化;
D、在混合溶液中,溶解度小的物质会先结晶析出;
解答:
解:A、工业上是电解熔融的氯化镁来制取金属镁,故A正确.
B、碳酸钠、碳酸氢钠和氢氧化钙之间均能反应,且都会出现白色沉淀,所以用澄清的石灰水不可鉴别NaHCO3和Na2CO3,故B错误;
C、第②步中,溴元素化合价从-1升高到0价,被氧化,第④步中,溴元素化合价从-1升高到0价,被氧化,故C正确;
D、向饱和食盐水中通入氨气以及二氧化碳,溶解度较小的碳酸氢钠会先析出,制取NaHCO3的反应是利用其溶解度小于NaCl,故D正确;
故选B.
B、碳酸钠、碳酸氢钠和氢氧化钙之间均能反应,且都会出现白色沉淀,所以用澄清的石灰水不可鉴别NaHCO3和Na2CO3,故B错误;
C、第②步中,溴元素化合价从-1升高到0价,被氧化,第④步中,溴元素化合价从-1升高到0价,被氧化,故C正确;
D、向饱和食盐水中通入氨气以及二氧化碳,溶解度较小的碳酸氢钠会先析出,制取NaHCO3的反应是利用其溶解度小于NaCl,故D正确;
故选B.
点评:本题是一道海水资源的综合利用方面的题目,属于综合知识的考查题,难度不大.

练习册系列答案
相关题目
下列化学用语错误的是( )
A、过氧化钡的电子式 | ||
B、钠-23的原子符号
| ||
| C、次氯酸的结构式 H-Cl-O | ||
| D、锰酸根MnO42- |
分类是重要的科学研究方法,下列物质归类不正确的是( )
| A、电解质:明矾、冰醋酸、硫酸钡 |
| B、酸性氧化物:CO2、SO2、NO、SiO2 |
| C、混合物:铝热剂、矿泉水、水玻璃、漂白粉 |
| D、同素异形体:C60、C70、金刚石 |
富含维生素A的食物为( )
| A、动物肝脏 | B、水果 |
| C、谷物 | D、面包 |
下列各组物理量中,都不随取水量的变化而变化的是( )
| A、水的沸点;蒸发水所需热量 |
| B、水的密度;水中通入足量CO2后溶液的pH |
| C、水的体积;水的质量 |
| D、水的物质的量;水的摩尔质量 |
下列实验装置设计正确且能达到相应实验目的是( )
A、 石油分馏 |
B、 制备乙酸乙酯 |
C、 铁制品表面镀锌 |
D、 构成银锌原电池 |
下列电离方程式正确的是( )
| A、醋酸溶于水:CH3COOH=CH3COO-+H+ |
| B、熔融状态下的NaHSO4:NaHSO4=Na++H++SO42- |
| C、碳酸氢钠溶于水:HCO3-+H2O?CO32-+H3O+ |
| D、硫化氢溶于水:H2S?2H++S2- |
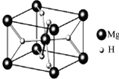 MgH2是金属氢化物储氢材料,其晶胞结构如图所示,已知该晶体的密度ag?cm-3,则晶胞的体积为
MgH2是金属氢化物储氢材料,其晶胞结构如图所示,已知该晶体的密度ag?cm-3,则晶胞的体积为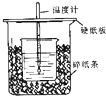 用50mL 0.50mol/L盐酸与50mL 0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
用50mL 0.50mol/L盐酸与50mL 0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题: