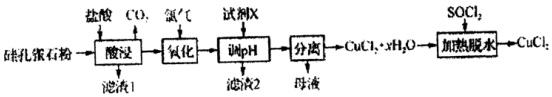
题目内容
5.下列化学反应与能量的相关叙述正确的是( )| A. | 太阳能、氢能、风能、地热能、海洋能和生物质能等属于新能源 | |
| B. | 根据能量守恒定律,生成物总能量一定等于反应物总能量 | |
| C. | 放热反应在常温下一定很容易发生 | |
| D. | 吸热反应在常温下一定不能发生 |
分析 A.煤、石油、天然气是化石燃料,太阳能、核能、地热能、海洋能、风能、氢能、生物质能等都是新能源;
B.化学反应过程中一定伴随能量的变化,反应物总能量与生成物总能量一定不相等,反应放热还是吸热决定于反应物和生成物能量高低;
C.放热反应在常温下不一定很容易发生,如物质的燃烧以及铝热反应等;
D.当反应物所具有的总能量低于生成物所具有的总能量的反应为吸热反应,与是否常温无关.
解答 解:A.煤、石油、天然气是化石燃料,太阳能、核能、地热能、海洋能、风能、氢能、生物质能等都是可再生、无污染的新能源,故A正确;
B.化学反应过程中一定伴随能量的变化,反应物总能量与生成物总能量一定不相等,反应中伴有声能、光能等,当反应物的能量高于生成物总能量时,反应是放热反应,反之吸热,故B错误;
C.化学反应一定伴随着能量的变化,当反应物所具有的总能量高于生成物所具有的总能量的反应为放热反应,反之为吸热反应,反应能否在常温下进行,与是否放热无关,如铝热反应为放热反应,但在高温下进行,故C错误;
D.氢氧化钡晶体与氯化铵的反应在常温下就可进行,为吸热反应,故D错误;
故选A.
点评 本题考查了化学反应能量变化的实质理解应用,为高频考点,侧重于学生的分析能力的考查,注意反应过程中能量守恒的分析应用,题目较简单.

练习册系列答案
相关题目
13.将过量的SO2通入下列溶液中,都能出现浑浊的组合是( )
①Ca(OH)2;②BaCl2;③Na2SiO3;④Ba(NO3)2;⑤苯酚钠;⑥Na2CO3 .
①Ca(OH)2;②BaCl2;③Na2SiO3;④Ba(NO3)2;⑤苯酚钠;⑥Na2CO3 .
| A. | ①②③⑥ | B. | ②⑤⑥ | C. | ③④⑤⑥ | D. | ③④⑤ |
20.25℃和101kpa时,乙烷、乙炔和丙烯组成的混合烃20mL与过量氧气混合并完全燃烧,除去水蒸气,恢复到原来的温度和压强,气体的总体积缩小了42mL,原混合烃中乙炔的体积分数为( )
| A. | 25% | B. | 40% | C. | 60% | D. | 75% |
17.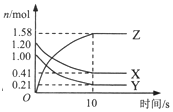 在2L的密闭绝热容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示.下列叙述不正确的是( )
在2L的密闭绝热容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示.下列叙述不正确的是( )
 在2L的密闭绝热容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示.下列叙述不正确的是( )
在2L的密闭绝热容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示.下列叙述不正确的是( )| A. | 反应开始到10s时,转化率:Y>X | |
| B. | 若前10s容器内的压强增加,说明生成Z的反应为放热反应 | |
| C. | 由图象可知前10s内生成Z的速率越来越快 | |
| D. | 若X为紫色,Y、Z无色,则10s后混合气体颜色不再变化 |
14.2.48g铁铜合金完全溶解于80mL 4.0mol•L-1稀硝酸中,得到标准状况下672mL NO气体(假设此时无其他气体产生),下列说法正确的是( )
| A. | 取反应后溶液,滴入几滴KSCN溶液,无血红色出现 | |
| B. | 该合金中铁与铜的物质的量之比是1:2 | |
| C. | 反应后溶液(忽略溶液体积变化)中c(H+)=2.5 mol•L-1 | |
| D. | 向反应后的溶液中加入2.0 mol•L-1NaOH溶液至金属离子恰好全部沉淀时,需加入NaOH溶液的体积是120 mL |
8.某同学用某种粗盐进行提纯实验,步骤如图.
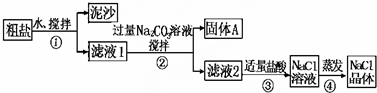
请回答:
(1)步骤①和②的操作相同,其名称是过滤.
(2)步骤④加热蒸发时要用玻璃棒不断搅拌,这是为了防止局部过热,造成固体(或溶液)飞溅,当蒸发皿中有较多量固体出现时,应停止加热(或熄灭酒精灯),用余热使水分蒸干.
(3)猜想和验证,补充完整相应的操作、现象和结论:

请回答:
(1)步骤①和②的操作相同,其名称是过滤.
(2)步骤④加热蒸发时要用玻璃棒不断搅拌,这是为了防止局部过热,造成固体(或溶液)飞溅,当蒸发皿中有较多量固体出现时,应停止加热(或熄灭酒精灯),用余热使水分蒸干.
(3)猜想和验证,补充完整相应的操作、现象和结论:
| 猜想 | 验证的操作 | 现象 | 结论 |
| 猜想Ⅰ:固体A中含有BaCO3 | 取少量固体A于试管中,先滴入过量稀硝酸(或稀盐酸),再滴入Na2SO4溶液 | 有气泡放出,无白色沉淀 | 猜想Ⅱ不成立 |
| 猜想Ⅱ:最后制得的NaCl晶体中还有Na2SO4 | 取少量NaCl晶体溶于试管中的蒸馏水, 先滴入BaCl2溶液,再滴入过量稀HNO3 | 有白色沉淀 | 猜想Ⅱ成立 |
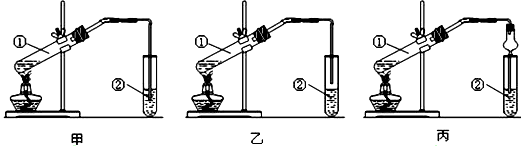
 CH3COOC2H5+H2O;
CH3COOC2H5+H2O;