题目内容
20.某微粒的核外电子排布式为1s22s22p6,下列说法不正确的是( )| A. | 可以确定该微粒为Ne | |
| B. | 对应元素可能位于元素周期表中第13列 | |
| C. | 它的单质可能是强还原剂 | |
| D. | 对应元素可能是电负性最大的元素 |
分析 已知某微粒的核外电子排布式为1s22s22p6,可知该微粒含有10个电子,常见的10电子微粒有Ne、F-、O2-、Na+、Mg2+、Al3+等,所以不能确定该微粒,但是可知其电子数为10,由此分析解答;
解答 解:A、该微粒可能是Ne,故A错误;
B、如果是铝位于位于元素周期表中第13列,故B正确;
C、Na+、Mg2+、Al3+对应单质是强还原剂,故C正确;
D、F-对应的元素是电负性最大的元素,故D正确;
故选A.
点评 本题考查了核外电子排布式为1s22s22p6的微粒,即10电子微粒,根据常见的10电子微粒分析即可,题目难度不大.

练习册系列答案
 新题型全程检测期末冲刺100分系列答案
新题型全程检测期末冲刺100分系列答案
相关题目
20.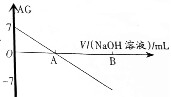 若用AG表示溶液的酸度(acidity grade),AG的定义为AG=lg[$\frac{c({H}^{+})}{c(O{H}^{-})}$].室温下实验室中用0.01mol•L-1的氢氧化钠溶液滴定20.00mL0.01mol•L-1的醋酸,滴定过程如图所示,下列叙述正确的是( )
若用AG表示溶液的酸度(acidity grade),AG的定义为AG=lg[$\frac{c({H}^{+})}{c(O{H}^{-})}$].室温下实验室中用0.01mol•L-1的氢氧化钠溶液滴定20.00mL0.01mol•L-1的醋酸,滴定过程如图所示,下列叙述正确的是( )
 若用AG表示溶液的酸度(acidity grade),AG的定义为AG=lg[$\frac{c({H}^{+})}{c(O{H}^{-})}$].室温下实验室中用0.01mol•L-1的氢氧化钠溶液滴定20.00mL0.01mol•L-1的醋酸,滴定过程如图所示,下列叙述正确的是( )
若用AG表示溶液的酸度(acidity grade),AG的定义为AG=lg[$\frac{c({H}^{+})}{c(O{H}^{-})}$].室温下实验室中用0.01mol•L-1的氢氧化钠溶液滴定20.00mL0.01mol•L-1的醋酸,滴定过程如图所示,下列叙述正确的是( )| A. | 室温下,醋酸的电离常数约为10-6 | |
| B. | A点时加入氢氧化钠溶液的体积为20.00mL | |
| C. | 若B点为40mL,所得溶液中:c(OH-)=c(CH3COO-)+c(H+)+2c(CH3COOH) | |
| D. | 反应过程中一定存在:0.01mol•L-1+c(OH-)=c(Na+)+c(H+)+c(CH3COOH) |
15.某无色溶液中加入氢氧化铝,氢氧化铝迅速溶解,则该溶液中一定能大量共存的离子组是( )
| A. | K+、Na+、NO3-、Cl- | B. | Na+、NH4+、SO42-、Cl- | ||
| C. | Na+、K+、I-、NO3- | D. | Na+、K+、MnO4-、Br- |
9.化学用语是学习化学的重要工具,下列用来表示物质变化的化学用语中,正确的是( )
| A. | 电解饱和食盐水时,阴极的电极反应式为:2Cl--2e-═Cl2↑ | |
| B. | 钢铁发生电化学腐蚀的正极反应式:Fe-2e-═Fe2+ | |
| C. | 粗铜精炼时,与电源负极相连的是纯铜,电极反应式为:Cu2++2e-═Cu | |
| D. | 氢氧燃料电池的负极反应式:O2+2H2O+4e-═4OH- |
10.下列解释事实的离子方程式不正确的是( )
| A. | Na放入水中,产生气体:2Na+2H2O═2Na++2OH-+H2↑ | |
| B. | 在澄清的石灰水中通入过量SO2:SO2+OH-═HSO3- | |
| C. | Al片与少量NaOH溶液反应,产生气体:2Al+2OH-+2H2O═2AlO2-+3H2↑ | |
| D. | 次氯酸钙溶液中通入少量SO2气体:Ca2++2ClO-+SO2+H2O═CaSO3↓+2HClO |
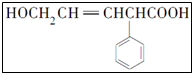 写出该有机物结构中含氧官能团的名称羟基、羧基.
写出该有机物结构中含氧官能团的名称羟基、羧基.




 ;
; .
.