题目内容
17.实验室需要100mL浓度分别是1moL.L-1、0.5mol•L-1、0.5mol.L-1的KCl、MgCl2、Na2SO4的混合液,现缺少KCl而用K2SO4和NaCl代替,其中能达到配制目的是( )| A. | 将0.1molK2SO4、0.1molNaCl、0.05molMgCl2溶于水制成100mL溶液 | |
| B. | 将0.05molK2SO4、0.1molNaCl、0.05molMgCl2溶于水制成100mL溶液 | |
| C. | 将0.1molK2SO4、0.05molNaCl、0.05molMgCl2溶于水制成100mL溶液 | |
| D. | 加入0.05molK2SO4、0.05molNaCl、0.1molMgCl2溶于水制成100mL溶液 |
分析 电解质溶液中离子浓度=电解质浓度×化学式中离子数目,根据n=cV计算配制各离子物质的量,再结合选项判断.
解答 解:配制溶液中:n(K+)=n(KCl)=0.1L×1mol/L=0.1mol,
n(Cl-)=n(KCl)+2n(MgCl2)=0.1L×1mol/L+0.1L×0.5mol/L×2=0.2mol,
n(Mg2+)=n(MgCl2)=0.1L×0.5mol/L=0.05mol,
n(Na+)=2n(Na2SO4)=0.1L×0.5mol/L×2=0.1mol,
n(SO42-)=n(Na2SO4)=0.1L×0.5mol/L=0.05mol,
A.溶液中n(K+)=2n(K2SO4)=0.1mol×2=0.2mol,与配制溶液中K+为0.1mol不相等,故A错误;
B.溶液中n(K+)=2n(K2SO4)=0.05mol×2=0.1mol,
n(Cl-)=n(NaCl)+2n(MgCl2)=0.1mol+0.05mol×2=0.2mol,
n(Mg2+)=n(MgCl2)=0.05mol,
n(Na+)=n(NaCl)=0.1mol,
n(SO42-)=n(K2SO4)=0.05mol,
与原溶液中同种离子物质的量相等,故B正确;
C.溶液中n(K+)=2n(K2SO4)=0.1mol×2=0.2mol,与配制溶液中K+为0.1mol不相等,故C错误;
D.溶液中n(Na+)=n(NaCl)=0.05mol,n(Cl-)=n(NaCl)+2n(MgCl2)=0.05mol+0.1mol×2=0.25mol,与配制溶液中Cl-为0.1mol、Na+物质的量为0.1mol不相等,故D错误;
故选:B.
点评 本题以溶液配制为载体考查物质的量有关计算,为高频考点,正确计算各微粒物质的量是解本题关键,注意离子浓度与物质浓度关系,为易错点.

 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案| A. | 与电源正极相连的是电解池的阴极 | B. | 与电源负极相连的是电解池的阴极 | ||
| C. | 在电解池的阳极发生的是氧化反应 | D. | 若用铁做阴极,则铁不会被氧化 |
| A. | NH3+HCl═NH4Cl | B. | H2S+Na2S═2NaHS | ||
| C. | 2CO+O2$\frac{\underline{\;点燃\;}}{\;}$2CO2 | D. | CO2+NaOH═NaHCO3 |
| A. | 1.34mol | B. | 1.0mol | C. | 0.94mol | D. | 0.52mol |
(2)已知:2NO2(g)═N2O4(g)△H1 2NO2(g)═N2O4(l)△H2
下列能量变化示意图中,正确的是(选填字母)A.
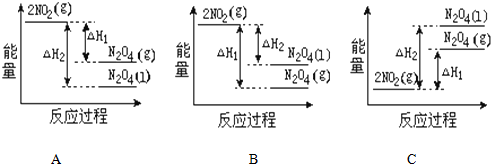
(3)依据盖斯定律可以对某些难以通过实验直接测定的化学反应的焓变进行推算.
已知:C(s,石墨)+O2(g)═CO2(g)△H1=-393.5kJ•mol-1
2H2(g)+O2(g)═2H2O(l)△H2=-571.6kJ•mol-1
2C2H2(g)+5O2(g)═4CO2(g)+2H2O(l)△H3=-2 599kJ•mol-1
根据盖斯定律,计算298K时由C(s,石墨)和H2(g)生成1mol C2H2(g)反应的焓变(列出简单的计算式):+226.7kJ•mol-1.
(4)甲醇是一种新型的汽车动力燃料,工业上可通过CO和H2化合来制备甲醇气体(结构简式为CH3OH). 已知某些化学键的键能数据如表:
| 化学键 | C-C | C-H | H-H | C-O | C≡O | H-O |
| 键能/kJ•mol-1 | 348 | 413 | 436 | 358 | 1072 | 463 |
| A. | 能电离出H+的化合物叫做酸 | |
| B. | 实验测得1mol某气体体积为22.4L,测定条件一定是标准状况 | |
| C. | 将饱和氯化铁溶液滴入稀氢氧化钠溶液中加热,可得氢氧化铁胶体 | |
| D. | 碱性氧化物一定是金属氧化物 |
| N≡N | O=O | N-N | N-H | O-H | |
| 键能(KJ•mol-1) | 946 | 497 | 154 | 391 | 463 |
Ⅱ.密闭容器中进行反应:3Fe(s)+4H2O(g)?Fe3O4(s)+4H2(g)△H<02反应的化学平衡表达式为K=$\frac{{c}^{4}({H}_{2})}{{c}^{4}({H}_{2}O)}$.
(2)已知:600℃时,上述反应的平衡常数K=16.现有如图1甲(恒温恒压)和如图1乙(恒温恒容)两容器,起始时按下表所示分别加入各物质,体积为2L,在600℃时反应经过一段时间后均达平衡.
| Fe | H2O(g) | Fe3O4 | H2 | |
| 甲/mol | 2.0 | 1.0 | 2.0 | 0.5 |
| 乙/mol | 2.0 | 2.0 | 2.0 | 1.0 |

①关于甲、乙容器,下列说法正确的是AB
A.反应开始时两容器内的逆反应速率:甲<乙
B.若甲容器内气体的密度不再变化,则说明反应已达到平衡状态
C.若乙容器内气体的压强不再变化,则说明反应已达到平衡状态
D.平衡后添加Fe3O4 ,两容器内的平衡均逆向移动
②投料后甲5min达平衡,则此段时间内的平均反应速率v(H2)=0.05mol/(L•min-1)
③平衡后若将乙容器体系温度突然降低100℃,如图2下述图象中能正确反映平衡移动过程中容器内变化情况的是B.
3为恒容绝热容器,进行上述反应,起始与平衡时的各物质的量见下表:
| Fe | H2O(g) | Fe3O4 | H2 | |
| 起始/mol | 3.0 | 3.0 | 0 | 0 |
| 平衡/mol | m | n | p | q |
| Fe | H2O(g) | Fe3O4 | H2 | |
| A/mol | 3.0 | 3.0 | 0 | 0 |
| B/mol | 0 | 0 | 3.0 | 3.0 |
| C/mol | m | n | p | q |