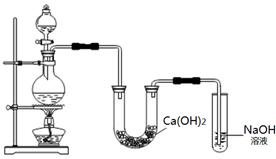
题目内容
(12分)标准状况下,将224LHCl气体溶于635 mL水中,所得盐酸的密度为1.18 g·cm-3。试计算:(1)所得盐酸的质量分数和物质的量浓度是多少?
(2)取出这种盐酸100 mL,稀释至1.18 L,求所得稀盐酸的物质的量浓度。
⑴ n(HCl)=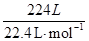 =10 mol,
=10 mol,
m(HCl)=10 mol×36.5 g·mol-1=365 g,
盐酸的质量分数w=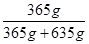 ×100%=36.5%,
×100%=36.5%,
c(HCl)=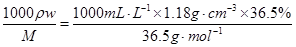 =11.8 mol·L-1。
=11.8 mol·L-1。
⑵根据c(浓)·V(浓)=c(稀)·V(稀)可知:
c(稀)=11.8 mol·L-1×0.1 L/1.18 L=1 mol·L-1。
解析试题解析:(1)n(HCl)=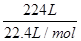 =10mol,m(HCl)=10mol×36.5g/mol=365g,溶液质量为365g+635mL
=10mol,m(HCl)=10mol×36.5g/mol=365g,溶液质量为365g+635mL
×1g/mL=1000g,则溶液的体积为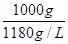 =0.847L,则c(HCl)=
=0.847L,则c(HCl)=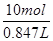 =11.8mol/L;②设稀释后
=11.8mol/L;②设稀释后
稀盐酸的物质的量浓度为cmol/L,根据稀释定律C浓V浓=C稀V稀可知:11.8mol/L×0.1L=cmol/L×1.18L,
所以X=01mol/L。
考点:物质的量浓度的相关计算

保护环境是每一个公民的责任。下列做法:①推广使用无磷洗衣粉;②城市垃圾分类处理;③ 推广使用一次性木质筷子;④推广使用清洁能源;⑤过量使用化肥、农药;⑥推广使用无氟冰箱。其中有利于保护环境的是( )
| A.①②④⑤ | B.②③④⑥ | C.①②④⑥ | D.③④⑤⑥ |
(14分)实验题
下图是某学校实验室从化学试剂商店买回的浓硫酸试剂标签上的部分内容。现用该浓硫酸配制200 mL 1.0 mol/L的稀硫酸。可供选用的仪器有: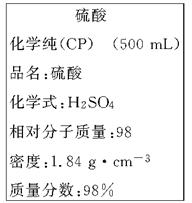
①玻璃棒;②烧瓶;③烧杯;④药匙;⑤量筒;⑥托盘天平。
请回答下列问题:
(1)配制上述稀硫酸时,还缺少的仪器有________________________(写仪器名称);
(2)标签所示浓硫酸的物质的量浓度为___________________________
(3)配制200 mL 1.0 mol/L的稀硫酸需要用量筒量取上述浓硫酸的体积为_______mL(计算结果保留小数点后1位),量取硫酸时应选用_______规格的量筒;
| A.10 mL | B.50 mL |
| C.100 mL | D.200 mL |
①用量筒取计算所需体积的浓硫酸;
②向量筒中加入少量蒸馏水,并用玻璃棒搅拌;
③立即将稀释后的溶液转入容量瓶中;
④然后将蒸馏水沿玻璃棒注入容量瓶直至刻度线;
⑤把容量瓶盖盖紧,上下颠倒摇匀。
你认为上述实验中错误的操作是______________________________(填序号)
(5)经过测定,某同学配制的稀硫酸浓度偏高,则可能的原因是_______(填序号)
①用量筒量取浓硫酸时,仰视刻度线
②容量瓶用蒸馏水洗涤后未经干燥
③洗涤烧杯内壁后将洗涤液弃去
④转移溶液时,不慎有少量溶液洒出
⑤定容时,俯视容量瓶刻度线
⑥定容、摇匀后发现溶液的凹液面低于刻度线
8分)用18.4mol·L-1密度为1.84g·mL-1的浓硫酸,配制100mL浓度为1mol·L-1的稀硫酸,其操作步骤如下:
| A.用量筒量取一定体积的浓硫酸,缓缓注入装有约50mL蒸馏水的烧杯里,并用玻璃棒搅拌。 |
| B.用约30 mL蒸馏水,分成三次洗涤烧杯和玻璃棒,将每次洗涤液都注入容量瓶里。 |
| C.将稀释后的硫酸小心地用玻璃棒引流入容量瓶。 |
| D.继续向容量瓶中加蒸馏水,液面至刻度线下1cm~2cm。 |
F.用胶头滴管向容量瓶里逐滴滴入蒸馏水,至凹液面最低点恰好与刻度线相切。
据此填写:
(1)计算A步骤中量筒量取的浓硫酸体积为 mL
(2)正确的操作顺序是____________________________。(填序号)
(3)除了玻璃棒、烧杯、量筒外,本操作还需用到的仪器有 。
(4)进行A步骤操作时,必须________________________后,才能进行后面的操作。
(5)如果在A步骤量取浓硫酸时,视线仰视,配制的稀硫酸的浓度将________。
(填“偏高”、“偏低”或“无影响”)。
(每空1分,共8分)实验室需要配制0.1 mol/L CuSO4溶液480 mL。按下列操作步骤填上适当的文字,以使整个操作完整。
(1)选择仪器。完成本实验所必需的仪器有:托盘天平(精确到0.1 g)、药匙、烧杯、玻璃棒、_______ _、________以及等质量的两片滤纸。
(2)计算,应选择下列正确________
| A.需要CuSO4固体8.0g | B.需要CuSO4·5H2O晶体12.0 g |
| C.需要CuSO4·5H2O晶体12.5 g | D.需要CuSO4固体7.7 g |
(4)溶解、冷却,该步实验中需要使用玻璃棒,目的是_________________ 。
(5)转移、洗涤。在转移时应使用________引流,需要洗涤烧杯2~3次是为了___________________。
(6)定容,摇匀。

(7)将配好的溶液静置一段时间后,倒入指定的试剂瓶,贴好标签,注明配制的时间、溶液名称及浓度。
(8)在配制过程中,某学生观察定容时液面情况如图所示,所配溶液的浓度会________(填“偏高”、“偏低”或“无影响”)。