题目内容
(10分)某实验小组用MnO2与浓盐酸混合加热制取Cl2,并将制得的氯气与潮湿的Ca(OH)2固体反应制取少量漂白粉。实验装置如下图: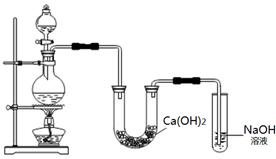
回答下列问题。
(1)漂白粉的有效成分是 (写化学式)。
(2)烧瓶中发生反应的化学方程式是 。
(3)温度较高时氯气与消石灰发生反应:6Cl2 + 6Ca(OH)2=5CaCl2 + Ca(ClO3)2 + 6H2O,该反应的氧化剂是 ,还原剂是 ,若反应消耗0.3mol Cl2,转移的电子数为 mol。
(4)在中学化学中,常用作氧化剂的物质有 、 (写两种),常用作还原剂的物质有 、
(写两种)。
(1)Ca(ClO)2 (1分)
(2)MnO2+4HCl(浓)  MnCl2+Cl2↑+2H2O (2分)
MnCl2+Cl2↑+2H2O (2分)
(3)Cl2 Cl2 0.5 (各1分,共3分)
(4)KMnO4、HNO3或其它合理答案,写名称或化学式均可
Cu、CO或其它合理答案,写名称或化学式均可 (各1分,共4分)
解析试题分析:(1)漂白粉是氯气与石灰乳反应产生氯化钙、次氯酸钙和水,其主要成分是氯化钙和次氯酸钙,有效成分是次氯酸钙,其化学式为:Ca(ClO)2;(2)烧瓶中为制取Cl2的反应:MnO2+4HCl(浓)  MnCl2+Cl2↑+2H2O,(3)在反应6Cl2 + 6Ca(OH)2=5CaCl2 + Ca(ClO3)2 + 6H2O中,Cl2从化合价0变为—1价和+5价,既是氧化剂也是还原剂,根据化学方程式可知,若反应消耗6mol Cl2,生成5 mol CaCl2,化合价从0变为—1价,转移的电子数为10 mol,则消耗0.3mol Cl2,转移的电子数0.5 mol;(4)在中学化学中,元素化合价较高的常用作氧化剂,如KMnO4、HNO3等,元素化合价较低的或活泼的金属常用作还原剂如Cu、CO等。
MnCl2+Cl2↑+2H2O,(3)在反应6Cl2 + 6Ca(OH)2=5CaCl2 + Ca(ClO3)2 + 6H2O中,Cl2从化合价0变为—1价和+5价,既是氧化剂也是还原剂,根据化学方程式可知,若反应消耗6mol Cl2,生成5 mol CaCl2,化合价从0变为—1价,转移的电子数为10 mol,则消耗0.3mol Cl2,转移的电子数0.5 mol;(4)在中学化学中,元素化合价较高的常用作氧化剂,如KMnO4、HNO3等,元素化合价较低的或活泼的金属常用作还原剂如Cu、CO等。
考点:考查氯气的制备及性质、氧化还原反应。

 愉快的寒假南京出版社系列答案
愉快的寒假南京出版社系列答案(8分)为验证氧化性Cl2 > Fe3+ > SO2,某小组用下图所示装置进行实验(夹持仪器和A中加热装置已略,气密性已检验)。
实验过程:
I. 打开弹簧夹K1~K4,通入一段时间N2,再将T型导管插入B中,继续通入N2,然后关闭K1、K3、K4。
Ⅱ. 打开活塞a,滴加一定量的浓盐酸,给A加热。
Ⅲ. 当B中溶液变黄时,停止加热,关闭K2。
Ⅳ. 打开活塞b,使约2mL的溶液流入D试管中,检验其中的离子。
Ⅴ. 打开K3和活塞c,加入70%的硫酸,一段时间后关闭K3。
Ⅵ. 更新试管D,重复过程Ⅳ,检验B溶液中的离子。
(1)过程Ⅰ的目的是 。
(2)棉花中浸润的溶液为 。
(3)A中发生反应的化学方程式 。
(4)若将制取的SO2通入酸性高锰酸钾溶液可使溶液褪色,其离子方程式为 。
(5)甲、乙、丙三位同学分别完成了上述实验,结论如下表所示。他们的检测结果一定能够证明氧化性Cl2 > Fe3+ > SO2的是 (填“甲”“乙”“丙”)。
| | 过程ⅣB溶液中含有的离子 | 过程ⅥB溶液中含有的离子 |
| 甲 | 有Fe3+无Fe2+ | 有SO42- |
| 乙 | 既有Fe3+又有Fe2+ | 有SO42- |
| 丙 | 有Fe3+无Fe2+ | 有Fe2+ |
下列叙述错误的是
| A.Al2(SO4)3可除去酸性废水中的悬浮颗粒 |
| B.氯气与石灰乳反应能得到含氯漂白剂 |
| C.燃煤时加入适量石灰石,可减少废气中SO2的排放 |
| D.工业上硝酸可用于制化肥、炸药和染料等 |
等质量的下列物质与足量稀硝酸反应,放出NO气体的物质的量最多的是
| A.FeO | B.Fe2O3 | C.FeSO4 | D.Fe3O4 |


 ),有一定的致癌作用。对苯二胺属于 (填“有机物”或“无机物” )。
),有一定的致癌作用。对苯二胺属于 (填“有机物”或“无机物” )。