题目内容
1.X、Y、Z、W为原子序数依次增加的四种短周期主族元素,且原子核外L电子层的电子数分别为4、5、8、8.Z元素原子核外K层与M层电子数相等.它们的最外层电子数之和为15.下列说法中正确的是( )| A. | Y元素最高价氧化物对应的水化物化学式为H2YO3 | |
| B. | 元素Y和W的非金属性强弱比较:Y<W | |
| C. | 原子半径由小到大的顺序为:Y<X<W<Z | |
| D. | X、Z两种元素的氧化物中所含化学键类型相同 |
分析 X、Y、Z、W均为的短周期主族元素,原子序数依次增加,且原子核外L电子层的电子数分别为4、5、8、8,则X是C元素,Y是N元素,Z、W第三周期元素,Z元素原子核外K层与M层电子数相等,则Z为Mg,它们的最外层电子数之和为15,W最外层电子数是15-4-5-2=3,则W是Al元素,据此解答.
解答 解:X、Y、Z、W均为的短周期主族元素,原子序数依次增加,且原子核外L电子层的电子数分别为4、5、8、8,则X是C元素,Y是N元素,Z、W第三周期元素,Z元素原子核外K层与M层电子数相等,则Z为Mg,它们的最外层电子数之和为15,W最外层电子数是15-4-5-2=3,则W是Al元素.
A.Y元素最高价氧化物对应的水化物化学式为HNO3,故A错误;
B.元素Y和W的非金属性强弱比较:Y(N)>W(Al),故B错误;
C.同周期自左而右原子半径减小,同主族自上而下原子半径增大,故原子半径Y(N)<X(C)<W(Al)<Z(Mg),故C正确;
D.X的氧化物为CO与二氧化碳,含有共价键,Z元素的氧化物为MgO,含有离子键,故D错误.
故选:C.
点评 本题考查结构性质位置关系应用,正确判断元素是解本题关键,熟练掌握核外电子排布与元素周期律,难度不大.

练习册系列答案
相关题目
11.一定条件下,在体积为10L的恒容密闭容器中,发生如下反应:2X(g)+Y(g)═Z (g),经60s达到平衡,生成0.3molZ,下列说法正确的是( )
| A. | 以Y浓度变化表示的反应速率为0.005mol/(L•s) | |
| B. | 将容器体积变为20L,Z的平衡浓度变为原来的$\frac{1}{2}$ | |
| C. | 若升高温度Y的转化率减小,则正反应为放热反应 | |
| D. | 达到平衡时,X与Y的浓度相等 |
12.对下列污染现象叙述正确的是( )
| A. | 臭氧空洞的形成主要与SO2有关 | |
| B. | 酸雨的形成主要与SO2有关 | |
| C. | 光化学烟雾的形成主要与NO2等有关 | |
| D. | 水体富营养化的形成主要与含氮、磷污水的排放有关 |
9.下列各组物质的变化,不能用勒夏特列原理解释的是( )
| A. | 打开啤酒盖,立即有气体逸出 | |
| B. | 新制的氯水在光照条件下颜色变浅 | |
| C. | NO2和N2O4的混合体系,压缩容器体积,颜色变深 | |
| D. | 工业生产硫酸的过程中使用过量的O2,以提高SO2的转化率 |
16.基态原子最外层电子排布为4s2的原子,其核外电子占有的原子轨道总数不可能是( )
| A. | 12 | B. | 13 | C. | 14 | D. | 15 |
13.化学与生产、生活、社会密切相关.下列说法中不正确的是( )
| A. | 蛋白质、棉花、PVC、淀粉都是混合物 | |
| B. | 废弃的玻璃、金属、纸制品是可回收利用的资源 | |
| C. | 铁在潮湿的空气中放置,易发生化学腐蚀而生锈 | |
| D. | 用CO2合成聚碳酸酯可降解塑料,实现“碳”的循环利用 |
10.下列有关实验操作,不正确的是( )
| A. | 用新制氢氧化铜检验牙膏中的甘油,现象是看到产生蓝色沉淀 | |
| B. | 为了使过饱和溶液中析出晶体,可用玻璃棒摩擦与溶液接触处的试管壁 | |
| C. | 做银镜反应实验后,试管内壁上的附着物用稀硝酸洗涤 | |
| D. | 用纸层析法分离Fe3+、Cu2+时,滤纸上的水做固定相,氨气做显色剂 |
11.某同学设计了由乙醇合成乙二醇的路线如下.下列说法正确的是( )
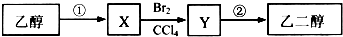
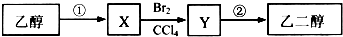
| A. | 步骤①的反应类型是氧化反应 | |
| B. | 等物质的量的乙醇、乙二醇完全燃烧,消耗氧气的量相同 | |
| C. | 1 mol乙二醇与乙酸若完全发生酯化反应,理论上可以增重120g | |
| D. | X可以使酸性高锰酸钾溶液褪色 |
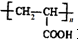 )的合成路线:
)的合成路线: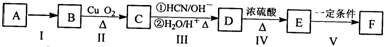
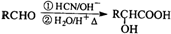 (R为烃基)
(R为烃基)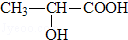

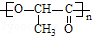 +nH2O.
+nH2O.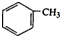 合成
合成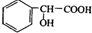 的合成路线
的合成路线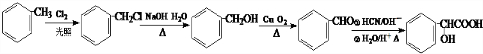 .
.