题目内容
11.某同学设计了由乙醇合成乙二醇的路线如下.下列说法正确的是( )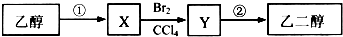
| A. | 步骤①的反应类型是氧化反应 | |
| B. | 等物质的量的乙醇、乙二醇完全燃烧,消耗氧气的量相同 | |
| C. | 1 mol乙二醇与乙酸若完全发生酯化反应,理论上可以增重120g | |
| D. | X可以使酸性高锰酸钾溶液褪色 |
分析 根据题中各各物质转化关系,乙醇发生消去反应生成乙烯,乙烯与溴发生加成生成二溴乙烷,二溴乙烷水解生成乙二醇,以此解答该题.
解答 解:根据题中各各物质转化关系,乙醇发生消去反应生成乙烯,乙烯与溴发生加成生成二溴乙烷,二溴乙烷水解生成乙二醇,
A.乙醇发生消去反应生成乙烯,步骤①的反应类型是消去反应,故A错误;
B.每摩尔CH3CH2OH完全燃烧消耗3mol氧气,每摩尔HOCH2CH2OH完全燃烧消耗2.5mol氧气,故B错误;
C.反应为HOCH2CH2OH+2CH3COOH?CH3COOCH2CH2OOCCH3+2H2O,反应生成水如不考虑反应的可逆性,1 mol乙二醇与乙酸若完全发生酯化反应,理论上可以增重84g,故C错误;
D.X为乙烯,含有碳碳双键,可被酸性高锰酸钾氧化,故D正确.
故选D.
点评 本题以有机物的合成考查有机物的结构与性质,为高频考点,题目难度不大,掌握乙醇和卤代烃的性质是解题的关键,答题时注意有机基础知识的灵活运用.

练习册系列答案
 激活思维优加课堂系列答案
激活思维优加课堂系列答案 活力试卷系列答案
活力试卷系列答案
相关题目
1.X、Y、Z、W为原子序数依次增加的四种短周期主族元素,且原子核外L电子层的电子数分别为4、5、8、8.Z元素原子核外K层与M层电子数相等.它们的最外层电子数之和为15.下列说法中正确的是( )
| A. | Y元素最高价氧化物对应的水化物化学式为H2YO3 | |
| B. | 元素Y和W的非金属性强弱比较:Y<W | |
| C. | 原子半径由小到大的顺序为:Y<X<W<Z | |
| D. | X、Z两种元素的氧化物中所含化学键类型相同 |
2.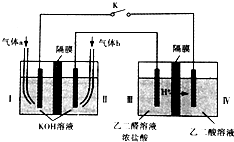 乙醛酸(HOOC-CHO)是有机合成的重要中间体.某同学组装了下图所示的电化学装置,电极材料Ⅰ~Ⅳ均为石墨,左池为氢氧燃料电池,右池为用“双极室成对电解法”生产乙醛酸,关闭K后,两极室均可产生乙醛酸,其中乙二醛与Ⅲ电极的产物反应生成乙醛酸.下列说法不正确的是( )
乙醛酸(HOOC-CHO)是有机合成的重要中间体.某同学组装了下图所示的电化学装置,电极材料Ⅰ~Ⅳ均为石墨,左池为氢氧燃料电池,右池为用“双极室成对电解法”生产乙醛酸,关闭K后,两极室均可产生乙醛酸,其中乙二醛与Ⅲ电极的产物反应生成乙醛酸.下列说法不正确的是( )
 乙醛酸(HOOC-CHO)是有机合成的重要中间体.某同学组装了下图所示的电化学装置,电极材料Ⅰ~Ⅳ均为石墨,左池为氢氧燃料电池,右池为用“双极室成对电解法”生产乙醛酸,关闭K后,两极室均可产生乙醛酸,其中乙二醛与Ⅲ电极的产物反应生成乙醛酸.下列说法不正确的是( )
乙醛酸(HOOC-CHO)是有机合成的重要中间体.某同学组装了下图所示的电化学装置,电极材料Ⅰ~Ⅳ均为石墨,左池为氢氧燃料电池,右池为用“双极室成对电解法”生产乙醛酸,关闭K后,两极室均可产生乙醛酸,其中乙二醛与Ⅲ电极的产物反应生成乙醛酸.下列说法不正确的是( )| A. | 电极Ⅱ上的电极反应式:O2+4e-+2H2O═4OH- | |
| B. | 电极Ⅳ上的电极反应式:HOOC-COOH+2e-+2H+═HOOC-CHO+H2O | |
| C. | 乙二醛与Ⅲ电极的产物反应生成乙醛酸的化学方程式:Cl2+OHC-CHO+H2O=2HCl+HOOC-CHO | |
| D. | 若有2 mol H+ 通过质子交换膜并完全参与反应,则该装置中生成的乙醛酸为1 mol |
19.元素周期律知识同族元素所形成的同一类型的化合物,其结构和性质都相似.化合物PH4I是一种白色晶体,下列对它的描述中不正确的是( )
| A. | 它是一种共价化合物 | |
| B. | 在加热时此化合物可以分解为PH3和HI或H2和I2 | |
| C. | 这种化合物能跟碱反应 | |
| D. | 该化合物可以由PH3和HI化合而成 |
6.下列对各不等量关系的判断,其中正确的是( )
| A. | 相等物质的量的物质燃烧所消耗O2的量:环已烷>苯>苯甲酸 | |
| B. | 密度:CCl4>H2O>乙酸乙酯 | |
| C. | 相等质量的物质燃烧所消耗O2的量:乙炔>乙烯>乙烷 | |
| D. | 熔点:戊烷>2,2-二甲基戊烷>2,3-二甲基丁烷 |
3.下列说法中正确的是( )
| A. | 周期表中所有的族都是由长、短周期的元素共同组成 | |
| B. | 最外层电子数相同的元素不一定都是同一族 | |
| C. | 非金属元素都是主族元素,金属元素都是副族元素 | |
| D. | 元素周期表中共有18个纵行,每个纵行都是一个族,共有18个族 |
1.在相同温度下等体积等物质的量浓度的4种稀溶液:①H2SO4 ②H2SO3 ③NaHSO3 ④Na2CO3中含带电微粒数由多到少的顺序是( )
| A. | ④>①>③>② | B. | ④=①>③>② | C. | ①>④>③>② | D. | ①=④>③=② |

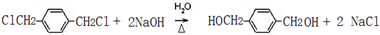 .
.