题目内容
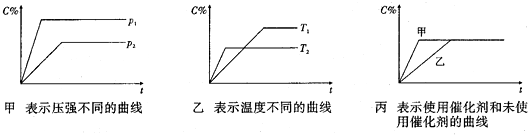
12.下列化学用语正确的是( )| A. | 氯分子的电子式:Cl:Cl | B. | 水分子的电子式: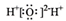 | ||
| C. | 氯离子的结构示意图: | D. | 质量数为37的氯原子:${\;}_{37}{\;}^{17}Cl$ |
分析 A.氯气的电子式中,氯原子最外层达到8电子稳定结构;
B.水是共价化合物,原子间以共用电子对形成共价键,不存在阴阳离子;
C.氯离子的核电荷数为17,核外电子总数为18,最外层达到8电子稳定结构;
D.元素符号的左上角为质量数、左下角为质子数.
解答 解:A.氯气分子中含有1个共价键,其正确的电子式为 ,故A错误;
,故A错误;
B.水为共价化合物,水分子正确的电子式为 ,故B错误;
,故B错误;
C.氯离子的核电荷数为17,核外电子总数为18,其结构示意图为: ,故C正确;
,故C正确;
D.氯原子的质子数为17,质量数为37的氯原子的表示方法为:1737Cl,故D错误;
故选C.
点评 本题考查了常见化学用语的表示方法,题目难度中等,涉及电子式、离子结构示意图、元素符号等知识,明确常见化学用语的概念及书写原则为解答关键,试题培养了学生的规范答题能力.

练习册系列答案
 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案 小学教材完全解读系列答案
小学教材完全解读系列答案
相关题目
2.玻璃、陶瓷和水泥是重要的无机非金属材料,它们的主要成分中都含有的元素是( )
| A. | 氮 | B. | 硫 | C. | 硅 | D. | 氯 |
3.对溶液、浊液、胶体的下列叙述错误的是( )
| A. | 都呈电中性 | B. | 都是混合物 | ||
| C. | 本质区别是分散质微粒直径大小 | D. | 都能透过滤纸 |
20.1mol如图所示的物质与足量NaOH溶液反应时,消耗NaOH的物质的量最多为( )


| A. | 3mol | B. | 4mol | C. | 3nmol | D. | 4nmol |
7.将氯气分别通入下列溶液中,由实验现象得出的结论正确的是( )
| 选项 | 氯气通入下列溶液中 | 实验现象 | 结论 |
| A | 滴有KSCN的FeCl2溶液 | 变红 | 氯气具有还原性 |
| B | 滴有酚酞的NaOH溶液 | 褪色 | 氯气具有漂白性 |
| C | 紫色石蕊溶液 | 先变红后褪色 | 氯气具有酸性、漂白性 |
| D | 少量氯气通入大量水中 | 溶液pH<7 呈浅黄绿色 | 氯气与水反应生成酸性物质, 且该反应为可逆反应 |
| A. | A | B. | B | C. | C | D. | D |
17.有A、B、C、D四种元素的离子A+、B2+、C-、D2-,它们具有相同的电子数,下列判断中,正确的是( )
| A. | A、B、C、D四种元素可能属于同一周期 | |
| B. | A、B、C、D四种元素一定属于短周期元素 | |
| C. | 原子序数由大到小的顺序是B>A>C>D | |
| D. | 离子半径由大到小的顺序是、B2+>A+>C->D2- |
4.某老师批阅学生实验报告,下列哪些学生是以科学的态度记录实验数据的( )
| A. | 甲学生用50mL量筒量取46.70mL浓盐酸 | |
| B. | 乙学生用广泛pH试纸测定溶液的酸碱性:pH=14.5 | |
| C. | 丙学生配NaOH溶液,用电子天平称取固体1.220g | |
| D. | 丁学生用红柄滴定管量取25.00mL0.1mol/L的盐酸 |
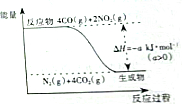 研究NOx、SO2、CO等大气污染气体的处理方法具有重要意义.
研究NOx、SO2、CO等大气污染气体的处理方法具有重要意义.