题目内容
下述实验设计能够达到目的是( )
| 编号 | 实验目的 | 实验设计 |
| A | 除去NO2 中少量的NO | 向混合气体中通入O2 |
| B | 除去乙酸乙酯中的乙酸杂质 | 加入氢氧化钠溶液,分液 |
| C | 证明苯分子中不含碳碳双键 | 向苯中加入酸性高锰酸钾溶液 |
| D | 证明氯元素的非金属性比硅强 | 将HCl通入Na2SiO3溶液中 |
| A、A | B、B | C、C | D、D |
考点:化学实验方案的评价
专题:实验评价题
分析:A.NO不稳定易被氧气氧化生成NO2;
B.NaOH和乙酸乙酯、乙酸都反应生成乙酸钠;
C.碳碳双键不稳定,易被酸性高锰酸钾溶液氧化;
D.元素的非金属性越强,其最高价氧化物的水化物酸性越强.
B.NaOH和乙酸乙酯、乙酸都反应生成乙酸钠;
C.碳碳双键不稳定,易被酸性高锰酸钾溶液氧化;
D.元素的非金属性越强,其最高价氧化物的水化物酸性越强.
解答:
解:A.NO不稳定易被氧气氧化生成NO2,但不易控制氧气的量,所以无法实现实验目的,故A错误;
B.NaOH和乙酸乙酯、乙酸都反应生成乙酸钠,所以不能用NaOH除杂,应该用饱和碳酸钠溶液除去乙酸,故B错误;
C.碳碳双键不稳定,易被酸性高锰酸钾溶液氧化,向苯中加入酸性高锰酸钾溶液,溶液不褪色,说明苯中不含碳碳双键,故C正确;
D.元素的非金属性越强,其最高价氧化物的水化物酸性越强,HCl不是Cl元素的最高价氧化物的水化物,所以不能据此判断Cl、Si元素的非金属性强弱,故D错误;
故选C.
B.NaOH和乙酸乙酯、乙酸都反应生成乙酸钠,所以不能用NaOH除杂,应该用饱和碳酸钠溶液除去乙酸,故B错误;
C.碳碳双键不稳定,易被酸性高锰酸钾溶液氧化,向苯中加入酸性高锰酸钾溶液,溶液不褪色,说明苯中不含碳碳双键,故C正确;
D.元素的非金属性越强,其最高价氧化物的水化物酸性越强,HCl不是Cl元素的最高价氧化物的水化物,所以不能据此判断Cl、Si元素的非金属性强弱,故D错误;
故选C.
点评:本题考查化学实验方案评价,涉及除杂、非金属性强弱判断、物质结构等知识点,综合性较强,明确物质的性质、实验原理即可解答,易错选项是D,题目难度中等.

练习册系列答案
相关题目
已知25℃时,电离平衡常数Ka(HF)=3.6×10-4 mol/L,溶度积常数Ksp(CaF2)=1.0×10-10 mol3/L3,Ksp(CaCO3)=5×10-9.现向50m L 0.2mol/L HF溶液中加入50mL 0.2mol?L-1 CaCl2溶液,则下列说法中,正确的是( )
| A、25℃时,0.1 mol/L HF溶液pH=1 |
| B、Ksp(CaF2)随温度和浓度的变化而变化 |
| C、向反应后的溶液中继续加入100m L 0.1 mol/L Na2CO3有CaCO3沉淀产生 |
| D、该体系中有CaF2沉淀产生,且反应后溶液中的F-浓度为1×10-4.5mol/L |
下列与有机物的结构、性质有关的叙述正确的是( )
| A、乙烯、氯乙烯、聚乙烯均可使酸性高锰酸钾溶液退色 |
| B、乙酸与乙醇可以发生酯化反应,又均可与氢氧化钠溶液反应 |
| C、糖类、油脂和蛋白质在一定条件下都能发生水解反应 |
| D、工业上通过石油分馏可以得到多种轻质液体燃料,通过煤的干馏可获得焦炭、煤焦油、焦炉气等多种化工原料 |
用如图装置进行实验,将液体A逐滴加入到固体B中,下列叙述正确的是( )
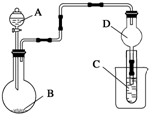

| A、若A为浓盐酸,B为MnO2,C中盛品红溶液,则C中溶液褪色 |
| B、实验仪器D可以起到防止溶液倒吸的作用 |
| C、若A为浓氨水,B为生石灰,C中盛AlCl3溶液,则C中先产生白色沉淀后沉淀又溶解 |
| D、若A为醋酸,B为贝壳,C中盛澄清石灰水,则C中溶液不变浑浊 |
在298K、1.01×105 Pa下,将22g CO2通入750mL 1mol/L NaOH溶液中充分反应,测得反应放出x kJ的热量.已知在该条件下,1mol CO2通入1L 2mol/L NaOH溶液中充分反应放出y kJ的热量.则CO2与NaOH溶液反应生成NaHCO3的热化学方程式是( )
| A、CO2(g)+NaOH(aq)═NaHCO3(aq)△H=-(2y-x)kJ/mol |
| B、CO2(g)+NaOH(aq)═NaHCO3(aq)△H=-(2x-y)kJ/mol |
| C、CO2(g)+NaOH(aq)═NaHCO3(aq)△H=-(4x-y)kJ/mol |
| D、2CO2(g)+2NaOH(l)═2NaHCO3(l)△H=-(8x-2y)kJ/mol |