题目内容
5.在指定溶液中一定能大量共存的离子组是( )| A. | 1.0mol•L-1KNO3溶液:H+、Fe2+、Cl-、SO42- | |
| B. | pH=1的溶液:NH4+、Al3+、SO42-、Br- | |
| C. | 0.1 mol•L-1FeCl3溶液:NH4+、H+、I-、SCN- | |
| D. | 常温下,在c(H+)水•c(OH-)水=10-26的溶液中:K+、Fe2+、Cl-、NO3- |
分析 A.硝酸钾在酸性条件下能够氧化亚铁离子;
B.pH=1的溶液中存在大量氢离子,四种离子之间不反应,都不与氢离子反应;
C.铁离子能够与碘离子、硫氰根离子反应;
D.常温下,在c(H+)水•c(OH-)水=10-26的溶液中存在大量氢离子或氢氧根离子,亚铁离子能够与氢氧根离子反应,硝酸根离子在酸性条件下能够氧化亚铁离子.
解答 解:A.H+、Fe2+与KNO3发生氧化还原反应,在溶液中不能大量共存,故A错误;
B.pH=1的溶液为酸性溶液,溶液中存在大量氢离子,NH4+、Al3+、SO42-、Br-之间不反应,都不与氢离子反应,在溶液中能够大量共存,故B正确;
C.FeCl3与I-、SCN-发生反应,在溶液中不能大量共存,故C错误;
D.常温下,在c(H+)水•c(OH-)水=10-26的溶液为酸性或碱性溶液,Fe2+、NO3-在酸性条件下发生氧化还原反应,Fe2+与碱性溶液中的氢氧根离子反应,在溶液中不能大量共存,故D错误;
故选B.
点评 本题考查离子共存的判断,为高考的高频题,属于中等难度的试题,注意明确离子不能大量共存的一般情况,如:能发生复分解反应的离子之间;能发生氧化还原反应的离子之间;能发生络合反应的离子之间(如 Fe3+和 SCN-)等;还应该注意题目所隐含的条件,如:溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;溶液的具体反应条件,如“氧化还原反应”、“加入铝粉产生氢气”;是“可能”共存,还是“一定”共存等.

练习册系列答案
相关题目
16.下列溶液不能用带磨口玻璃塞的试剂瓶保存的是( )
| A. | 稀硫酸 | B. | NaOH | C. | 氢氟酸 | D. | 浓盐酸 |
13. 已知T、X、Y、Z、Q是中学化学常见的五种元素,其中T、X、Y、Z的信息如表.
已知T、X、Y、Z、Q是中学化学常见的五种元素,其中T、X、Y、Z的信息如表.
请根据信息回答有关问题:
(1)写出与Y2互为等电子体的分子式CO.
(2)在相同状况下,Y的简单氢化物的沸点高于Z的氢化物,其原因是NH3分子间能形成氢键,而HCl分子间没有氢键.
(3)T、X、Y三种元素的电负性由大到小的顺序(填元素符号)是N>C>Na.
(4)元素Q的原子序数是X与Z的原子序数之和.
①该元素基态原子的外围电子排布式为3d84s2.
②元素Q与元素T、Y、Z分别形成平面型的[Q(TY)4]2-和四面体的[QZ4]2-,其中T与Y、Q与Z成键时中心原子采用的杂化方式分别是sp;sp3.
③在方框内画出[QZ4]2-的空间构型(用虚线表示空间构型的轮廓)并表示出中心离子与配原子之间的化学键.
 已知T、X、Y、Z、Q是中学化学常见的五种元素,其中T、X、Y、Z的信息如表.
已知T、X、Y、Z、Q是中学化学常见的五种元素,其中T、X、Y、Z的信息如表.| 元素 | 结构或性质信息 |
| T | 原子的L层上s电子数等于p电子数. |
| X | 元素的原子半径是第三周期主族元素中最大的. |
| Y | 空气中含其单质,原子的最外层未成对电子数是该元素所在周期中最多的. |
| Z | 单质常温、常压下是气体.原子的M层上有1个未成对的p电子. |
(1)写出与Y2互为等电子体的分子式CO.
(2)在相同状况下,Y的简单氢化物的沸点高于Z的氢化物,其原因是NH3分子间能形成氢键,而HCl分子间没有氢键.
(3)T、X、Y三种元素的电负性由大到小的顺序(填元素符号)是N>C>Na.
(4)元素Q的原子序数是X与Z的原子序数之和.
①该元素基态原子的外围电子排布式为3d84s2.
②元素Q与元素T、Y、Z分别形成平面型的[Q(TY)4]2-和四面体的[QZ4]2-,其中T与Y、Q与Z成键时中心原子采用的杂化方式分别是sp;sp3.
③在方框内画出[QZ4]2-的空间构型(用虚线表示空间构型的轮廓)并表示出中心离子与配原子之间的化学键.
20.下列各组热化学方程式中,Q1<Q2的是( )
| A. | CH4(g)+2O2(g)→CO2(g)+2H2O(g)+Q1 CH4(g)+$\frac{3}{2}$O2(g)→CO(g)+2H2O(g)+Q2 | |
| B. | S(s)+O2(g)→SO2(g)+Q1 S(g)+O2(g)→SO2(g)+Q2 | |
| C. | H2(g)+Br2(g)→2HBr(q)+Q1 H2(g)+Cl2(g)→2HCl(q)+Q2 | |
| D. | HCl(aq)+NaOH(aq)→NaCl(aq)+H2O(l)+Q1 CH3COOH(aq)+NaOH(aq)→CH3COONa(aq)+H2O(l)+Q2 |
10.下列说法正确的是( )
| A. |  分子中至少有10个碳原子处于同一平面 分子中至少有10个碳原子处于同一平面 | |
| B. | 蛋白质和油脂都属于高分子化合物,一定条件下能水解 | |
| C. | 等物质的量的苯和苯甲酸完全燃烧消耗的氧气的量不相等 | |
| D. | 经测定乙二醇和苯组成的混合物中氧的质量分数为8%,则此混合物中碳的质量分数是84% |
17.下列说法错误的是( )
| A. | 铅笔芯的主要原料是石墨,儿童使用时不会引起中毒 | |
| B. | CO有毒,生有煤炉的居室可放置数盆清水,能有效地吸收CO,防止煤气中毒 | |
| C. | “汽水”浇灌植物有一定的道理,其中CO2的释放,有利于植物的光合作用 | |
| D. | 硅的提纯与应用,促进了半导体元件与集成芯片业的发展,可以说“硅是信息技术革命的催化剂” |
14.下列有关说法错误的是( )
| A. | 钠在空气中充分燃烧时先熔化再燃烧,最后所得的产物只有Na2O2 | |
| B. | 金属钠不能保存在密闭容器中,应保存在煤油中 | |
| C. | 铝制品在生活中非常普遍,是因为铝的化学性质不活泼 | |
| D. | 铁在潮湿的空气中形成的氧化物疏松,不能保护内层金属,故铁制品往往需涂保护层 |
15.某化学兴趣小组设计如下实验方案.将浓硫酸与铜片反应制备SO2并进行相关实验探究,实验装置如图所示:
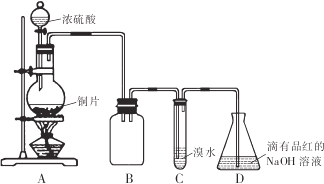
请回答下列问题:
(1)装置B的作用是防倒吸(或安全瓶)
(2)设计装置C的目的是验证SO2的还原性,装置C中发生反应的离子方程式是SO2+Br2+2H2O=4H++SO42-+2Br-.装置D中NaOH全部转化为NaHSO3的标志是溶液由红色变为无色.
(3)向NaHSO3溶液中加入NaCl0溶液时,反应有三种可能的情况:
I.HSO3-与ClO-恰好反应
Ⅱ.NaClO不足
Ⅲ.NaClO过量
甲同学分别取上述混合溶液于试管中,通过下列实验确定该反应属于哪一种情况,请完成下表:(已知酸性:H2SO3>H2CO3>HCl0)
(4)请设计简单实验证明:室温下HS03-的电离平衡常数Ka与水解平衡常数Kb,的相对大小:常温下,用pH试纸(或pH计)测定NaHS03溶液的pH,若pH<7,则Ka>Kb,若pH>7,则Ka<Kb.

请回答下列问题:
(1)装置B的作用是防倒吸(或安全瓶)
(2)设计装置C的目的是验证SO2的还原性,装置C中发生反应的离子方程式是SO2+Br2+2H2O=4H++SO42-+2Br-.装置D中NaOH全部转化为NaHSO3的标志是溶液由红色变为无色.
(3)向NaHSO3溶液中加入NaCl0溶液时,反应有三种可能的情况:
I.HSO3-与ClO-恰好反应
Ⅱ.NaClO不足
Ⅲ.NaClO过量
甲同学分别取上述混合溶液于试管中,通过下列实验确定该反应属于哪一种情况,请完成下表:(已知酸性:H2SO3>H2CO3>HCl0)
| 序号 | 实 验操作 | 现 象 | 结 论 |
| ① | 加几小块CaCO3固体 | 有气泡产生 | I或Ⅱ |
| ② | 滴加少量淀粉KI溶液,振荡 | Ⅲ | |
| ③ | 滴加少量溴水,振荡 | Ⅱ | |
| ④ | 滴加少量酸性KMn04溶液、振荡 | 溶液为紫色 |