题目内容
2. 在金属或非金属底物材料上,用NaBH4进行“化学镀”镀镍,可以得到坚硬、耐腐蚀的保护层(3Ni3B+Ni),反应的离子方程式为:20Ni2++16BH4-+34OH-+6H2O═2(3Ni3B+Ni)+10B(OH)4-+35H2↑
在金属或非金属底物材料上,用NaBH4进行“化学镀”镀镍,可以得到坚硬、耐腐蚀的保护层(3Ni3B+Ni),反应的离子方程式为:20Ni2++16BH4-+34OH-+6H2O═2(3Ni3B+Ni)+10B(OH)4-+35H2↑(1)Ni2+基态核外电子排布式为1s22s22p63s23p63d8.
(2)与BH4-互为等电子体的一种分子为CH4、SiH4(填化学式).
(3)B (OH)4-中硼原子轨道的杂化类型是sp3;1molB(OH)4-中含有σ键的数目为8mol.
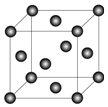
(4)Ni的晶胞结构如图所示,镍晶体中每个镍原子周围距离最近的镍原子数目为12.
(5)NiCl2•6H2O在SOCl2气流中加热时,生成NiCl2和两种酸性气体.写出该反应的化学方程式:NiCl2•6H2O+6SOCl2$\frac{\underline{\;\;△\;\;}}{\;}$NiCl2+6SO2+12HCl.
分析 (1)Ni是28号元素,根据原子核外电子排布规律书写;
(2)根据等电子体概念可知,原子数和价电子数都相等的微粒互为等电子体,据此分析;
(3)B (OH)4-中B原子有4个σ键,无孤电子对,轨道的杂化类型为sp3杂化;1个B (OH)4-中含有4个氢氧键和4个硼氧键;
(4)以顶点Ni原子为研究对象,与之最近的Ni原子位于面心,每个顶点为8个晶胞共用,据此进行解答;
(5)NiCl2•6H2O在SOCl2气流中加热时,生成NiCl2和两种酸性气体即SO2和HCl,据此书写方程式.
解答 解:(1)Ni是28号元素,根据原子核外电子排布规律可知,Ni2+的基态核外电子排布式为1s22s22p63s23p63d8,故答案为:1s22s22p63s23p63d8;
(2)根据等电子体概念可知,原子数和价电子数都相等的微粒互为等电子体,BH4-离子中有5个原子,价电子数为8,所以与BH4-离子互为等电子体的一种分子为CH4、SiH4等,故答案为:CH4、SiH4等;
(3)B (OH)4-中B原子有4个σ键,无孤电子对,轨道的杂化类型为sp3杂化;1个B (OH)4-中含有4个氢氧键和4个硼氧键,则其中含有8个σ键,1molB(OH)4-中含有σ键的数目为8mol,
故答案为:sp3;8;
(4)以顶点Ni原子为研究对象,与之最近的Ni原子位于面心,每个顶点为8个晶胞共用,Ni晶体中每个Ni原子周围距离最近的Ni原子数目为$\frac{3×8}{2}$=12,
故答案为:12;
(5)NiCl2•6H2O在SOCl2气流中加热时,生成NiCl2和两种酸性气体即SO2和HCl,则反应方程式为:NiCl2•6H2O+6SOCl2$\frac{\underline{\;\;△\;\;}}{\;}$NiCl2+6SO2+12HCl,故答案为:NiCl2•6H2O+6SOCl2$\frac{\underline{\;\;△\;\;}}{\;}$NiCl2+6SO2+12HCl.
点评 本题主要考查了核外电子的排布、等电子体、分子的空间构型、原子杂化、晶胞的计算等知识,中等难度,注重基础知识的考查.

| A. | 天平(附砝码) | B. | 10毫升的量筒 | C. | 20毫升的量筒 | D. | 100毫升的量筒 |
| A. | 塑料 | B. | 淀粉 | C. | 油脂 | D. | 纤维素 |
| A. | 称量时,将NaOH固体直接放在托盘天平的右盘上 | |
| B. | 将NaOH固体在烧杯中溶解,所得溶液冷却到室温,再转移至容量瓶中 | |
| C. | 定容时如果加水超过了刻度线,用胶头滴管直接吸出多余部分 | |
| D. | 定容摇匀后发现溶液体积低于刻度线,再补加少量蒸馏水至刻度线 |
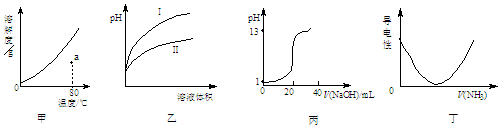
| A. | 图甲表示KNO3的溶解度曲线,a点所示溶液是80℃时KNO3的不饱和溶液 | |
| B. | 图乙表示用水稀释pH相同的盐酸和醋酸,I表示醋酸,II表示盐酸 | |
| C. | 图丙表示0.1000 mol•L-1NaOH溶液滴定20.00 mL 0.1000 mol•L-1CH3COOH溶液所得到的滴定曲线 | |
| D. | 图丁表示将NH3通入醋酸溶液的过程中,溶液导电性的变化 |
| A. | Mg原子的电子式 Mg: | B. | 二氧化硅的结构式O=Si=O | ||
| C. | 14O的原子结构示意图  | D. | 氯化钠的分子式 NaCl |
| A. | 加入过量氨水,有白色沉淀生成,则原溶液一定有Al3+ | |
| B. | 加入KSCN溶液,溶液变红,则原溶液一定有Fe2+ | |
| C. | 加入盐酸酸化的BaCl2溶液,有白色沉淀生成,则原溶液一定有SO42- | |
| D. | 加入NaOH溶液,产生气体使湿润的红色石蕊试纸变蓝,则原溶液一定有NH4+ |
| A. | (b-2a)/3mol•L-1 | B. | (b-2a)/2mol•L-1 | C. | (2b-a)/3mol•L-1 | D. | (2b-a)/2 mol•L-1 |