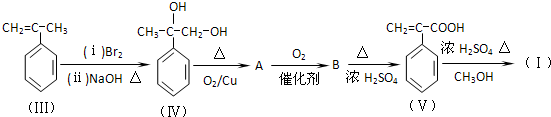
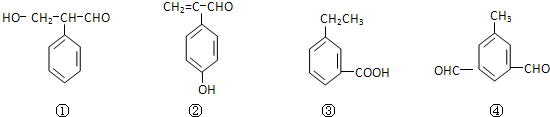
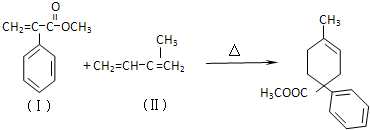题目内容
将6 mol H2和3 molCO充入容积为0.5 L的密闭容器中,进行如下反应:2H2(g)+CO(g)?CH3OH(g),6秒末时H2的物质的量为3mol,试计算
(1)在6秒内用氢气表示的平均反应速率是多少?
(2)6秒末时CO的物质的量的浓度为多少?
(1)在6秒内用氢气表示的平均反应速率是多少?
(2)6秒末时CO的物质的量的浓度为多少?
考点:化学平衡的计算
专题:
分析:依据化学平衡三段式列式计算
2H2(g)+CO(g)?CH3OH(g),
起始量(mol) 6 3 0
变化量(mol) 3 1.5 1.5
6s末量(mol) 3 1.5 1.5
(1)反应速率
;
(2)浓度c=
;
2H2(g)+CO(g)?CH3OH(g),
起始量(mol) 6 3 0
变化量(mol) 3 1.5 1.5
6s末量(mol) 3 1.5 1.5
(1)反应速率
| △c |
| △t |
(2)浓度c=
| n |
| V |
解答:
解:依据化学平衡三段式列式计算
2H2(g)+CO(g)?CH3OH(g),
起始量(mol) 6 3 0
变化量(mol) 3 1.5 1.5
6s末量(mol) 3 1.5 1.5
(1)在6秒内用氢气表示的平均反应速率=
=
=1mol/L?s;
答:在6秒内用氢气表示的平均反应速率为1mol/L?s;
(2)6秒末时CO的物质的量的浓度c=
=
=3mol/L;
答:6秒末时CO的物质的量的浓度为3mol/L;
2H2(g)+CO(g)?CH3OH(g),
起始量(mol) 6 3 0
变化量(mol) 3 1.5 1.5
6s末量(mol) 3 1.5 1.5
(1)在6秒内用氢气表示的平均反应速率=
| △c |
| △t |
| ||
| 6S |
答:在6秒内用氢气表示的平均反应速率为1mol/L?s;
(2)6秒末时CO的物质的量的浓度c=
| n |
| V |
| 1.5mol |
| 0.5L |
答:6秒末时CO的物质的量的浓度为3mol/L;
点评:本题考查反应速率定量表示方法、化学平衡三段式的计算,难度不大,掌握基础是关键.

练习册系列答案
 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案 期末好成绩系列答案
期末好成绩系列答案
相关题目
pH=a的某电解质溶液中,插入两支惰性电极通直流电一段时间后,溶液的pH>a,则该电解质可能是( )
| A、H2SO4 |
| B、NaOH |
| C、AgNO3 |
| D、Na2SO4 |
常温下,0.1mol/L醋酸溶液的pH=3.将该温度下0.2mol/L醋酸溶液和 0.2mol/L醋酸钠溶液等体积混合后,混合液的pH=4.7,下列说法正确的是( )
| A、该温度下,0.0lmol/L醋酸溶液的pH=4 |
| B、该温度下,用0.1mol/L醋酸和0.01 mol/L醋酸分别完全中和等体积0.1 mol/L的NaOH溶液,消耗两醋酸的体积比为1:10 |
| C、该温度下,0.01mol/L醋酸溶液中由水电离出的c(H+)=10-11mol/L |
| D、该温度下,0.2mol/L醋酸溶液和0.2mol/L醋酸钠溶液等体积混合后,混合液中c(CH3COO-)>c(CH3COOH)>c(Na+)>c(H+)>c(OH-) |
以惰性电极电解0.1mol/LCuSO4溶液100ml,若阳极上产生的气体的物质的量为0.010mol,则阴极上析出Cu的质量为( )
| A、0.64 g |
| B、1.28 g |
| C、2.56 g |
| D、5.12g |
 1994年度诺贝尔化学奖授予为研究臭氧作出特殊贡献的化学家.O3能吸收有害紫外线,保护人类赖以生存的空间.O3分子的结构如图5,呈V型,键角116.5℃.三个原子以一个O原子为中心,与另外两个O原子分别构成一个非极性共价键;中间O原子提供2个电子,旁边两个O原子各提供1个电子,构成一个特殊的化学键--三个O原子均等地享有这4个电子.请回答:
1994年度诺贝尔化学奖授予为研究臭氧作出特殊贡献的化学家.O3能吸收有害紫外线,保护人类赖以生存的空间.O3分子的结构如图5,呈V型,键角116.5℃.三个原子以一个O原子为中心,与另外两个O原子分别构成一个非极性共价键;中间O原子提供2个电子,旁边两个O原子各提供1个电子,构成一个特殊的化学键--三个O原子均等地享有这4个电子.请回答: