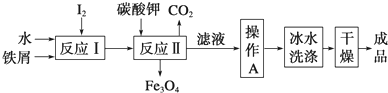
题目内容
19.研究物质的合成或制备是有机化学、无机化学的重要任务之一.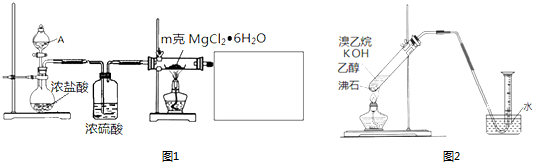
(1)某实验小组探究实验室制备无水氯化镁的方法,设计了图1装置
①分液漏斗中的A物质是浓硫酸(填试剂名称).
②利用中学常见的仪器,空白方框内补充完整实验装置
 .
.可选择的试剂有:A.稀NaOH溶液 B.无水氯化钙 C.稀硫酸 D.浓硫酸
③假设实验过程中 MgCl2•6H2O 未水解,不用任何试剂用最简单的方法检验MgCl2•6H2O 是否完全转化为MgCl2.写出实验方法称量所得产物质量,若质量为$\frac{95m}{203}$g,说明MgCl2?6H2O完全转化为MgCl2,否则未完全.
(2)实验室制备并收集纯净乙烯
①有的同学通过乙醇制备乙烯,写出相关化学方程式:CH3CH2OH$→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O.
该实验除乙醇外,所需的试剂或用品(不包括仪器)有浓硫酸、氢氧化钠溶液、沸石.
②有的同学探究其它制备乙烯的方法,他设计了图2装置制备乙烯.实验结果是量筒内壁附着较多无色油状液体,且得到很少量的气体.
请分析气体产率很低的原因主要是加热温度过高,溴乙烷大量挥发,也可能是溴乙烷发生副反应等.
为增大气体产率,在右图装置的基础上,提出一点改进措施:增加冷凝回流装置等.
分析 (1)①②加热氯化镁晶体失去结晶水得到无水氯化镁,由于氯化镁易水解,应在HCl氛围中加热分解,A中液体为浓硫酸,与圆底烧瓶中浓盐酸混合,发生大量的热,利用HCl逸出,洗气瓶中浓硫酸干燥HCl,利用氢氧化钠溶液吸收尾气中HCl,防止污染空气,注意防止倒吸,还要防止氢氧化钠溶液中水蒸气导致氯化镁水解,尾气处理装置与加热装置之间需要连接盛放氯化钙的干燥管(或盛放浓硫酸的洗气瓶);
③称量加热后固体的质量可以判断氯化镁晶体是否完全分解;
(2)①乙醇在浓硫酸作用下发生消去反应生成乙烯,反应中会发生副反应,有二氧化碳、二氧化硫生成,用氢氧化钠溶液吸收除去二氧化碳、二氧化硫,液体加热需要防止暴沸,还需要加入沸石;
②方案中利用溴乙烷发生消去反应生成乙烯,利用图中装置制备乙烯,实验结果是量筒内壁附着较多无色油状液体,且得到很少量的气体,说明生成乙烯很少,大量的溴乙烷挥发,可以可以增加冷凝回流装置,有利于溴乙烷冷凝回流,可以利用水浴加热控制反应温度,减少溴乙烷挥发.
解答 解:(1)加热氯化镁晶体失去结晶水得到无水氯化镁,由于氯化镁易水解,应在HCl氛围中加热分解,A中液体为浓硫酸,与圆底烧瓶中浓盐酸混合,发生大量的热,利用HCl逸出,洗气瓶中浓硫酸干燥HCl,利用氢氧化钠溶液吸收尾气中HCl,防止污染空气,注意防止倒吸,还要防止氢氧化钠溶液中水蒸气导致氯化镁水解,尾气处理装置与加热装置之间需要连接盛放氯化钙的干燥管(或盛放浓硫酸的洗气瓶);
①由上述分析可知,分液漏斗中的A物质是浓硫酸,故答案为:浓硫酸;
②利用氢氧化钠溶液吸收尾气中HCl,防止污染空气,且防止倒吸,还要在尾气处理装置与加热装置之间需要连接盛放氯化钙的干燥管(或盛放浓硫酸的洗气瓶),防止氯化镁水解,需要补充完整实验装置为: 等,
等,
故答案为: 等;
等;
③实验过程中MgCl2?6H2O未水解,mg晶体的物质的量为$\frac{m}{203}$mol,完全分解得到氯化镁为$\frac{m}{203}$mol×95g/mol=$\frac{95m}{203}$g,称量所得产物质量,若质量为$\frac{95m}{203}$g,说明MgCl2?6H2O完全转化为MgCl2,否则未完全,
故答案为:称量所得产物质量,若质量为$\frac{95m}{203}$g,说明MgCl2?6H2O完全转化为MgCl2,否则未完全;
(2)①乙醇在浓硫酸作用下发生消去反应生成乙烯,反应方程式为:CH3CH2OH$→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O,
反应中会发生副反应,有二氧化碳、二氧化硫生成,用氢氧化钠溶液吸收除去二氧化碳、二氧化硫,液体加热需要防止暴沸,还需要加入沸石,除乙醇外,所需的试剂或用品(不包括仪器)有:浓硫酸、氢氧化钠溶液、沸石,
故答案为:CH3CH2OH$→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O;浓硫酸、氢氧化钠溶液、沸石;
②方案中利用溴乙烷发生消去反应生成乙烯,利用图中装置制备乙烯,实验结果是量筒内壁附着较多无色油状液体,且得到很少量的气体,说明生成乙烯很少,大量的溴乙烷挥发,
气体产率很低的原因主要是:加热温度过高,溴乙烷大量挥发,也可能是溴乙烷发生副反应等;
为增大气体产率,可以增加冷凝回流装置,有利于溴乙烷冷凝回流,可以利用水浴加热,便于控制温度等,减少溴乙烷挥发,
故答案为:加热温度过高,溴乙烷大量挥发,也可能是溴乙烷发生副反应等;增加冷凝回流装置等.
点评 本题考查化学实验制备,属于拼合型题目,明确制备原理是解题关键,侧重考查学生对原理、装置、操作的分析评价,是对学生综合能力的考查,难度中等.

 阅读快车系列答案
阅读快车系列答案| A. | 65g锌与足量稀硫酸反应产生的气体体积为22.4L | |
| B. | 标准状况下,以任意比混合的H2和CO气体共8.96L,在足量氧气中充分燃烧时消耗氧气的分子数为0.2NA | |
| C. | 0.2mol H2O2在MnO2催化下充分反应生成O2的数目为0.2NA | |
| D. | 同温同压下,1mol H2在空气中充分燃烧,消耗O2的体积为22.4L |
| A. | 将磁性氧化铁溶于盐酸:Fe3O4+8H+═3Fe3++4H2O | |
| B. | NaHCO3溶液中加入HCl:CO32-+2H+═CO2↑+H2O | |
| C. | 向NaAlO2溶液中通入过量CO2制Al(OH)3:CO2+AlO2-+2H2O═Al(OH)3↓+HCO3- | |
| D. | “84消毒液”和“洁厕灵”(主要成分为盐酸)混合使用会产生有毒气体:$ClO_3^-$+5Cl-+6H+═3Cl2↑+3H2O |
 己二酸
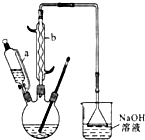
己二酸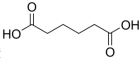 是一种工业上具有重要意义的有机二元酸,在化工生产、有机合成工业、医药、润滑剂制造等方面都有重要作用,能够发生成盐反应、酯化反应等,并能与二元醇缩聚成高分子聚合物等,己二酸产量居所有二元羧酸中的第二位.实验室合成己二酸的反应原理和实验装置示意图如下:
是一种工业上具有重要意义的有机二元酸,在化工生产、有机合成工业、医药、润滑剂制造等方面都有重要作用,能够发生成盐反应、酯化反应等,并能与二元醇缩聚成高分子聚合物等,己二酸产量居所有二元羧酸中的第二位.实验室合成己二酸的反应原理和实验装置示意图如下: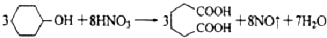
可能用到的有关数据如下:
| 物质 | 密度(20℃) | 熔点 | 沸点 | 溶解性 | 相对分子质量 |
| 环己醇 | 0.962g/cm3 | 25.9℃ | 160.8℃ | 20℃时水中溶解度3.6g,可混溶于乙醇、苯 | 100 |
| 乙二酸 | 1.36g/cm3 | 152℃ | 337.5℃ | 在水中的溶解度:15℃时,1.44g,25℃时2.3g,易溶于乙醇,不溶于苯 | 146 |
I、在三口烧瓶中加入16mL 50%的硝酸(密度为1.31g/cm3),再加入1~2粒沸石,滴液漏斗中盛放有5.4mL环己醇.
Ⅱ、水浴加热三口烧瓶至50℃左右,移去水浴,缓慢滴加5~6滴环己醇,摇动三口烧瓶,观察到有红棕色气体放出时再慢慢滴加剩下的环己醇,维持反应温度在60℃~65℃之间.
Ⅲ、当环己醇全部加入后,将混合物用80℃~90℃水浴加热约10min(注意控制温度),直至无红棕色气体生成为止.
IV、趁热将反应液倒入烧杯中,放入冰水浴中冷却,析出晶体后过滤、洗涤得粗产品.V、粗产品经提纯后称重为5.7g.
请回答下列问题:
(1)仪器b的名称为球形冷凝管(或冷凝管).
(2)向三口烧瓶中滴加环己醇时,要控制好环己醇的滴入速率,防止反应过于剧烈导致温度迅速上升,否则.可能造成较严重的后果,试列举一条可能产生的后果:反应液暴沸冲出冷凝管;放热过多可能引起爆炸;产生的二氧化氮气体来不及被碱液吸收而外逸到空气中.
(3)已知用NaOH溶液吸收尾气时发生的相关反应方程式为:
2NO2+2NaOH═NaNO2+NaNO3+H2O,NO+NO2+2NaOH═2NaNO2+H2O;如果改用纯碱溶液吸收尾气时也能发生类似反应,则相关反应方程式为:2NO2+Na2CO3═NaNO2+NaNO3+CO2、NO+NO2+Na2CO3═2NaNO2+CO2.
(4)为了除去可能的杂质和减少产品损失,可分别用冰水和苯洗涤晶体.
(5)粗产品可用重结晶 法提纯(填实验操作名称).本实验所得到的己二酸产率为75%.

(1)操作Ⅰ为过滤.操作Ⅱ用到的玻璃仪器有烧杯、分液漏斗.
(2)操作Ⅱ、操作Ⅲ的主要目的是除杂、富集铜元素.
(3)小组成员利用CuSO4溶液与Na2CO3溶液混合反应,制备环保型木材防腐剂Cu2(OH)2CO3悬浊液.多次实验发现所得蓝色悬浊液颜色略有差异,查阅资料表明,可能由于条件控制不同使其中混有较多Cu(OH)2或Cu4(OH)6SO4.
已知Cu(OH)2、Cu2(OH)2CO3,Cu4(OH)6SO4均难溶于水,可溶于酸;分解温度依次为80℃、200℃、300℃.
设计实验检验悬浊液成分,完成表中内容.
限选试剂:2mol•L-1 HCl、1mol•L-1 H2SO4、0.1mol•L-1 NaOH、0.1mol•L-1BaCl2、蒸馏水.仪器和用品自选.
| 实验步骤 | 预期现象和结论 |
| 步骤1:取少量悬浊液,过滤,充分洗涤后,取滤渣于试管中,:加入过量2mol/L的盐酸溶液,充分振荡,再滴加几滴0.1mol/L氯化钡溶液 | 有白色沉淀生成说明悬浊液中混有Cu4(OH)6SO4. |
| 步骤2:另取少量悬浊液于试管中,将试管放入装有沸水的小烧杯中水浴加热一段时间取出试管观察 | 试管中有黑色固体生成,说明悬浊液中混有Cu(OH)2. |
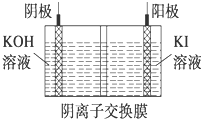 碘被称为“智力元素”,科学合理地补充碘可防治碘缺乏病,KI、KIO3曾先后用于加碘盐中.
碘被称为“智力元素”,科学合理地补充碘可防治碘缺乏病,KI、KIO3曾先后用于加碘盐中.