题目内容
2.写出下列反应的离子方程式:(1)石灰石与稀硝酸反应:CaCO3+2H+=Ca2++H2O+CO2↑;
(2)氢氧化钡溶液与稀硫酸反应:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O;
(3)锌与硫酸铜溶液反应:Cu2++Zn=Zn2++Cu;
(4)三氧化二铁溶于稀盐酸:Fe2O3+6H+=2Fe3++3H20.
分析 (1)石灰石主要成分为碳酸钙,碳酸钙与稀硝酸反应生成硝酸钙和二氧化碳气体,碳酸钙需要保留化学式;
(2)氢氧化钡与稀硫酸反应生成硫酸钡沉淀和水;
(3)锌与硫酸铜发生置换反应生成硫酸锌和铜;
(4)氧化铁与盐酸反应生成氯化铁和水.
解答 解:(1)石灰石溶于稀硝酸,大理石需要保留化学式,反应的离子方程式为:CaCO3+2H+=Ca2++H2O+CO2↑,
故答案为:CaCO3+2H+=Ca2++H2O+CO2↑;
(2)氢氧化钡与稀硫酸反应生成硫酸钡沉淀和水,反应的离子方程式为:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O,
故答案为:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O;
(3)锌与硫酸铜溶液反应的离子方程式为:Cu2++Zn=Zn2++Cu,
故答案为:Cu2++Zn=Zn2++Cu;
(4)氧化铁和盐酸反应生成氯化铁和水,反应的离子反应为:Fe2O3+6H+=2Fe3++3H20,
故答案为:Fe2O3+6H+=2Fe3++3H20.
点评 本题考查了离子方程式的书写,题目难度中等,明确反应的实质是解题关键,注意掌握离子方程式的书写原则,试题培养了学生灵活应用所学知识的能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
10.工业上制取漂白粉的最初原料一般是( )
| A. | NaCl、CaCO3 | B. | CaCO3、Cl2 | C. | Cl2、Ca(OH)2 | D. | Ca(OH)2、NaCl |
17.NA 表示阿伏加德罗常数,则下列说法正确的是( )
| A. | 1 mol Mg 原子变成 Mg2+时失去的电子数为2 NA | |
| B. | 标准状况下,11.2 L H2O所含的电子数为5 NA | |
| C. | 常温常压下,16g O2 与16gO3含有的原子数为相同 | |
| D. | 0.1 mol/L K2SO4 溶液中含有 K+为0.2 NA |
7.下列各表述与示意图一致的是( )
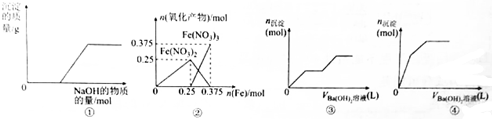

| A. | 图①表示向Ca(HCO3)2溶液中滴加NaOH溶液时,产生沉淀的质量与加入NaOH的物质的量之间的关系 | |
| B. | 图②表示向n(HNO3)=1mol的稀HNO3中加入Fe时,氧化产物(还原产物为NO)的物质的量与Fe的物质的量之间的关系 | |
| C. | 图③可用来表示向含有4mol HCl和1mol MgSO4的混合溶液中滴加Ba(OH)2溶液时,产生沉淀的物质的量(n)与加入Ba(OH)2溶液体积(V)之间的关系 | |
| D. | 图④表示向一定质量的明矾溶液中滴加Ba(OH)2溶液时,产生沉淀的物质的量(n)与加入Ba(OH)2溶液体积(V)之间的关系 |
8.化学在物质制备和环保领域有着重要的运用.
Ⅰ高铁酸盐在能源、环保等方面有着广泛的用途.湿法、干法制备高铁酸盐的原理如下表所示.
(1)工业上用湿法制备高铁酸钾(K2FeO4)的流程如图1所示:
①反应I的化学方程式为2NaOH+Cl2═NaCl+NaClO+H2O.
②反应II的离子方程式为3ClO-+10OH-+2Fe3+=2FeO42-+3Cl-+5H2O.
③已知25℃时Fe(OH)3的Ksp=4.0×10-38,反应II后溶液中c(Fe3+)=4×10-5mol•L-1,则Fe3+完全沉淀时的pH=3.
(2)高铁酸钾是一种理想的水处理剂,其处理水的原理为高铁酸钾有强氧化性,能杀菌消毒,在水中被还原生成Fe(OH)3胶体、有吸附性起净水作用.
(3)干法制备K2FeO4的反应中氧化剂与还原剂的物质的量之比为3﹕1.
(4)高铁电池是正在研制中的可充电干电池,图2为该电池和常用的高能碱性电池的放电曲线,由此可得出的高铁电池的优点有放电时间长、工作电压稳定.

Ⅰ高铁酸盐在能源、环保等方面有着广泛的用途.湿法、干法制备高铁酸盐的原理如下表所示.
| 湿法 | 强碱性介质中,Fe(NO3)3与NaClO反应生成紫红色高铁酸盐溶液 |
| 干法 | Fe2O3、KNO3、KOH混合加热共熔生成紫红色高铁酸盐和KNO2等产物 |
①反应I的化学方程式为2NaOH+Cl2═NaCl+NaClO+H2O.
②反应II的离子方程式为3ClO-+10OH-+2Fe3+=2FeO42-+3Cl-+5H2O.
③已知25℃时Fe(OH)3的Ksp=4.0×10-38,反应II后溶液中c(Fe3+)=4×10-5mol•L-1,则Fe3+完全沉淀时的pH=3.
(2)高铁酸钾是一种理想的水处理剂,其处理水的原理为高铁酸钾有强氧化性,能杀菌消毒,在水中被还原生成Fe(OH)3胶体、有吸附性起净水作用.
(3)干法制备K2FeO4的反应中氧化剂与还原剂的物质的量之比为3﹕1.
(4)高铁电池是正在研制中的可充电干电池,图2为该电池和常用的高能碱性电池的放电曲线,由此可得出的高铁电池的优点有放电时间长、工作电压稳定.

 ,在该反应中氧化剂是KMnO4,氧化剂和还原剂的物质的量之比为1:5,产生标准状况下33.6LCl2时,转移电子的物质的量为3mol.
,在该反应中氧化剂是KMnO4,氧化剂和还原剂的物质的量之比为1:5,产生标准状况下33.6LCl2时,转移电子的物质的量为3mol.
 +Br2$\stackrel{Fe}{→}$
+Br2$\stackrel{Fe}{→}$ +HBr.
+HBr.