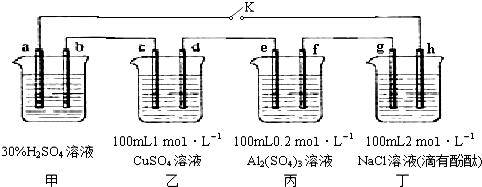
题目内容
11.在加入铝粉能产生H2的溶液中下列各组离子可能大量共存的是( )| A. | NO3- K+[Al(OH)4]- OH- | B. | Na+ Ba2+ Mg2+ HCO3- | ||
| C. | NO3- Mg2+ K+ Cl- | D. | NH4+ NO3- CO32- Na+ |
分析 在加入铝粉能产生H2的溶液中存在大量氢离子或氢氧根离子,
A.四种离子之间不反应,都不与氢氧根离子反应;
B.碳酸氢根离子与氢离子和氢氧根离子反应;
C.镁离子与氢氧根离子反应,硝酸根离子在酸性条件下具有强氧化性,与铝反应不会生成氢气;
D.铵根离子与氢氧根离子反应,碳酸根离子与氢离子反应.
解答 解:在加入铝粉能产生H2的溶液为酸性或强碱性溶液,溶液中存在大量氢离子或氢氧根离子,
A.NO3-、K+、[Al(OH)4]-、OH-之间不发生反应,都不与氢氧根离子反应,在碱性溶液中能够大量共存,故A正确;
B.HCO3-与氢离子、氢氧根离子反应,在溶液中一定不能大量共存,故B错误;
C.Mg2+与氢氧根离子反应,NO3-在酸性溶液中具有强氧化性,与铝反应不会生成氢气,故C错误;
D.NH4+与氢氧根离子反应,CO32-与氢离子反应,在溶液中一定不能大量共存,故D错误;
故选A.
点评 本题考查离子共存,为高考的高频题,题目难度中等,注意明确离子不能大量共存的一般情况:能发生复分解反应的离子之间;能发生氧化还原反应的离子之间等;还应该注意题目所隐含的条件,如:溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;溶液的具体反应条件,如“氧化还原反应”、“加入铝粉产生氢气”;是“可能”共存,还是“一定”共存等;试题侧重对学生基础知识的训练和检验,有利于培养学生灵活运用基础知识解决实际问题的能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
2.下列化学用语正确的是( )
| A. | 氯原子的结构示意图: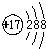 | |
| B. | 硫酸的电离方程式:H2SO4═H2++SO42- | |
| C. | 苏打粉的化学式:NaHCO3 | |
| D. | 明矾的化学式:KAl(SO4)2•12H2O |
19.下列反应中,反应后固体物质增重的是( )
| A. | 氢气通过灼热的CuO粉末 | B. | 将锌粒投入Cu(NO3)2溶液 | ||
| C. | CO高温下还原Fe2O3 | D. | 二氧化碳通过Na2O2粉末 |
6.下列离子检验的操作或说法正确的是( )
| A. | 某溶液加入几滴KSCN溶液后不变色再滴加几滴氯水后,溶液变红,说明该溶液一定有Fe2+ | |
| B. | 某溶液滴加AgNO3溶液产生白色沉淀,说明该溶液一定含Cl- | |
| C. | 某溶液加入稀盐酸产生无色无味气体,将气体通入澄清石灰水中,溶液变浑浊,说明该溶液一定有CO32- | |
| D. | 某溶液滴加盐酸酸化的BaCl2溶液后,有白色沉淀产生,说明该溶液一定含SO42- |
16.Cl-的物质的量浓度相同的NaCl MgCl2 AlCl3三种溶液,当溶液的体积比为3:2:1时,三种溶液中NaCl MgCl2 AlCl3的物质的量浓度之比为( )
| A. | 1:1:1 | B. | 1:2:3 | C. | 6:3:2 | D. | 2:3:6 |
20. 甲~庚元素在周期表中的相对位置如下表,己的最高氧化物对应水化物有强脱水性,甲和丁在同一周期,甲原子最外层与最内层具有相同电子数.下列判断不正确的是( )
甲~庚元素在周期表中的相对位置如下表,己的最高氧化物对应水化物有强脱水性,甲和丁在同一周期,甲原子最外层与最内层具有相同电子数.下列判断不正确的是( )
 甲~庚元素在周期表中的相对位置如下表,己的最高氧化物对应水化物有强脱水性,甲和丁在同一周期,甲原子最外层与最内层具有相同电子数.下列判断不正确的是( )
甲~庚元素在周期表中的相对位置如下表,己的最高氧化物对应水化物有强脱水性,甲和丁在同一周期,甲原子最外层与最内层具有相同电子数.下列判断不正确的是( )| A. | 丙与戊的原子序数相差28 | |
| B. | 气态氢化物的稳定性:庚>己>戊 | |
| C. | 丁的氧化物可用于制造光导纤维 | |
| D. | 常温下,甲和乙的单质均能与水剧烈反应 |
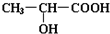
 .
.