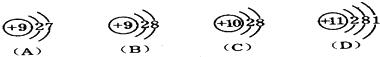题目内容
16.R、W、X、Y、Z为原子序数递增的同一短周期元素,下列说法一定正确的是(m、n均为正整数)( )| A. | 若R(OH)n为强碱,W(OH)n+1也为强碱 | |
| B. | 若HnXO${\;}_{{m}_{\;}}$为强酸,则Y是活泼非金属元素 | |
| C. | 若Y的最低化合价为-2,则Z的最高正化合价为+6 | |
| D. | 若X的最高正化合价为+5,则五种元素都是非金属元素 |
分析 A.同周期元素从左到右元素的金属性逐渐减弱,最高价氧化物对应水化物的碱性减弱;
B.HnXOm为强酸,则X为N或S,同周期元素从左到右元素非金属性逐渐增强;
C.若Y的最低化合价为-2,则Y处于ⅦA族;
D.若X的最高正化合价为+5,当X为P,则R一定为金属元素.
解答 解:A.同周期元素从左到右元素的金属性逐渐减弱,若R(OH)n为强碱,则W(OH)m不一定为强碱,故A错误;
B.HnXOm为强酸,则X为N或S,同周期元素从左到右元素非金属性逐渐增强,Y是活泼非金属元素,故B正确;
C.若Y的最低化合价为-2,则Y处于ⅦA族,Z的最低价为-1价,其最高正化合价为+7(F元素除外),故C错误;
D.X的最高正化合价为+5,当X为P,则R一定为金属元素,故D错误.
故选B.
点评 本题考查同周期元素的性质的递变规律,注意把握同周期元素的性质的递变规律和在元素周期表中的可能位置,题目难度不大.

练习册系列答案
相关题目
6.下列对一些实验事实的理论解释正确的是( )
| 选项 | 实验事实 | 理论解释 |
| A | 氧化性:HClO>HClO4 | HClO4分子中非羟基氧原子数目较多 |
| B | 沸点:SiO2>CO2 | 相对分子质量越大沸点越高 |
| C | 密度:干冰>冰 | 干冰晶体属于分子密堆积 |
| D | 分解温度:MgO>NaCl | MgO晶格能大于NaCl |
| A. | A | B. | B | C. | C | D. | D |
7.12.8g Cu与过量的9mol/L 100mL HNO3反应,硝酸的还原产物为NO2和NO,反应结束后测得溶液中c(H+)=3mol/L,则反应后溶液中所含NO3-的物质的量( )
| A. | 0.3mol | B. | 0.5mol | C. | 0.7mol | D. | 0.75mol |
11.下列表示物质结构的化学用语或模型正确的是( )
| A. | 苯(C6H6)分子的比例模型: | B. | CO2的电子式: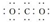 | ||
| C. | Cl-离子的结构示意图: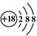 | D. | 乙烯的结构式:CH2=CH2 |
1.下列过程属于物理变化的是( )
| A. | 石油分馏 | B. | 煤的气化 | C. | 煤的干馏 | D. | 海水提溴 |
8.以下是“海带中碘元素的分离及检验”实验过程中某个环节中的实验步骤,其中正确的是( )
| A. | 将干海带用蒸馏水泡发 | |
| B. | 将海带灰用蒸馏水浸泡,取其浸取液,向其中加入四氯化碳 | |
| C. | 向海带灰的浸取液中,加入少量稀硫酸和过氧化氢溶液 | |
| D. | 将海带灰的浸取液加入分液漏斗中进行分液分离 |
9.有A、B、C、D四块金属片,用导线两两相连插入稀硫酸中,可以组成各种原电池.若A和B相连时,A为负极;C与D相连时,C溶解,D上有氢气生成;A与C相连时,C为正极;B与D相连时,电子由D极经导线流向B极,则这四种金属的活泼性由强到弱的顺序为( )
| A. | A>B>C>D | B. | A>C>D>B | C. | C>A>D>B | D. | B>D>C>A |