题目内容
2.Ⅰ.过氧化钡常温下缓慢分解,不溶于水,常用作氧化剂、漂白剂等.请回答:
(1)BaO2的电子式为
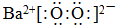 .
.(2)BaO2在有水存在下,通过与二氧化碳作用,分解生产过氧化氢,其化学反应方程式为BaO2+H2O+CO2=BaCO3+H2O2.
(3)BaCl2在氨水中与H2O2反应可得到BaO2沉淀,用一个粒子反应方程式表示其原理Ba2++H2O2+2NH3•H2O=BaO2+2NH4++2H2O.
(4)配平下列反应方程式:
2MnO4-+5BaO2+16H+=5Ba2++2Mn2++5O2↑+8H2O
Ⅱ.2.38化合物甲,在空气中充分煅烧后,得固体残留物乙1.82g和标准状况下896mL气体A,该气体能使品红溶液褪色,加热后品红又恢复至原色.所得固体残留物乙能全部溶于稀硫酸的溶液B,能部分溶于NaOH溶液中得溶液C和0.8g残留物.取少量溶液B,滴加KSCN溶液,发现溶液变为血红色.
(1)用离子反应方程式解释溶液变为血红色的原因:Fe3++3SCN-=Fe(SCN)3.
(2)写出形成溶液C的化学方程式:Al2O3+2NaOH=2NaAlO2+H2O.
分析 Ⅰ.(1)依据过氧化钠结构可知过氧化钡中钡离子与过氧根离子通过离子键结合,过氧根中两个氧原子通过共价键结合;
(2)过氧化钡与二氧化碳和水反应生成碳酸钡和过氧化氢;
(3)BaCl2在氨水中与H2O2反应生成BaO2沉淀和氯化铵和水;
(4)反应中+7价锰化合价降为+2价,过氧化钡中-1价氧化升高为氧气中0价,依据氧化还原反应得失电子守恒结合原子个数守恒配比书写方程式.
Ⅱ.2.38g化合物甲,在空气中充分煅烧后,得固体残留物乙1.82g和标准状况下896mL即0.04mol气体A,该气体能使品红溶液褪色,加热后品红溶液恢复至原色,所以A是SO2,所得固体残留物乙能全部溶于稀硫酸得溶液B,加KSCN溶液,发现溶液变为血红色,所以B是硫酸铁溶液,固体残留物中存在氧化铁,固体残留物部分溶于NaOH溶液中,所以一定含有氧化铝,固体残留物乙1.82g是氧化铝和氧化铁的混合物,其中Fe2O3是0.8g,Al2O3是1.82g-0.8g=1.02g,据此推断化合物甲中一定含有的元素是Fe、Al、S,n(Al)=0.02mol,n(Fe)=0.02mol,n(S)=0.04mol,得到物质的分子式,根据物质的性质进行回答即可.
解答 解:Ⅰ.(1)过氧化钡中,钡离子与过氧根离子通过离子键结合,氧原子之间通过共价键结合,过氧化钡的电子式: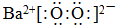 ;
;
故答案为: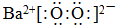 ;
;
(2)过氧化钡与二氧化碳和水反应生成碳酸钡和过氧化氢,化学方程式:BaO2+H2O+CO2=BaCO3+H2O2;
故答案为:BaO2+H2O+CO2=BaCO3+H2O2;
(3)BaCl2在氨水中与H2O2反应生成BaO2沉淀和氯化铵和水,离子方程式:Ba2++H2O2+2NH3•H2O=BaO2+2NH4++2H2O;
故答案为:Ba2++H2O2+2NH3•H2O=BaO2+2NH4++2H2O;
(4)反应中+7价锰化合价降为+2价,过氧化钡中-1价氧化升高为氧气中0价,要使得失电子守恒则高锰酸根离子系数为2,过氧化钡系数为5,依据原子个数守恒,反应的方程式:2MnO4-+5BaO2+16H+=2Mn2++5O2↑+5Ba2++8H2O;
故答案为:2;5;16H+;5;2;5O2↑;8;
Ⅱ.2.38g化合物甲,在空气中充分煅烧后,得固体残留物乙1.82g和标准状况下896mL即0.04mol气体A,该气体能使品红溶液褪色,加热后品红溶液恢复至原色,所以A是SO2,所得固体残留物乙能全部溶于稀硫酸得溶液B,加KSCN溶液,发现溶液变为血红色,所以B是硫酸铁溶液,固体残留物中存在氧化铁,固体残留物部分溶于NaOH溶液中,所以一定含有氧化铝,固体残留物乙1.82g是氧化铝和氧化铁的混合物,其中Fe2O3是0.8g,Al2O3是1.82g-0.8g=1.02g,据此推断化合物甲中一定含有的元素是Fe、Al、S,n(Al)=0.02mol,n(Fe)=0.02mol,n(S)=0.04mol,得到物质的分子式为FeAlS4.
(1)加KSCN溶液,发现溶液变为血红色,所以B中存在铁离子,发生反应为:Fe3++3SCN-=Fe(SCN)3,故答案为:Fe3++3SCN-=Fe(SCN)3;
(2)氧化铝可以和氢氧化钠之间反应生成偏氯酸钠和水,即:Al2O3+2NaOH=2NaAlO2+H2O.故答案为:Al2O3+2NaOH=2NaAlO2+H2O;
点评 本题考查考查较为综合,涉及电子式、化学方程式书写,依据过氧化钠结构书写过氧化钡电子式,书写方程式时应注意氧化还原反应中得失电子守恒、原子个数守恒规律,注意对既有知识的迁移应用,题目难度中等.

 培优口算题卡系列答案
培优口算题卡系列答案 开心口算题卡系列答案
开心口算题卡系列答案 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案| A. | 原子的核电荷数依次增多 | B. | 原子核外电子层数依次增多 | ||
| C. | 原子核外次外层电子数依次增多 | D. | 原子量依次增大 |
①化学反应达到化学平衡时,反应物与生成物的浓度(含量)保持不变;
②化学反应达到化学平衡时,整个反应处于停滞状态;
③平衡状态是指可逆反应在给定条件下进行的程度.
| A. | 只有① | B. | 只有①② | C. | 只有①③ | D. | ①②③ |
| A. | CH4与Cl2光照取代反应 | B. | 乙醇与浓硫酸共热 | ||
| C. | 乙炔在空气中的燃烧反应 | D. | 乙烯与氯化氢加成 |
| A. | (NH4)2SO4浓溶液和CuSO4溶液都能使蛋白质沉淀析出 | |
| B. | 苯中含有碳碳双键,其性质跟乙烯相似 | |
| C. | 乙烯使溴水褪色和苯与溴水混合振荡后水层变为无色原理相同 | |
| D. | 聚乙烯塑料的老化是由于发生了加成反应 |
 .A+、C2-、D-中离子半径最小的是Na+.(用具体离子符号表示)
.A+、C2-、D-中离子半径最小的是Na+.(用具体离子符号表示)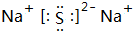 .
.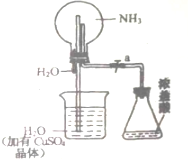 如图,室温下,挤压胶头滴管.待现象发生时,再打开活塞a,烧瓶中能观察到的现象是先形成蓝色喷泉,然后有蓝色沉淀生成后溶解变为蓝色溶液,有关的化学方程式是NH3+H2O=NH3.H2O、CuSO4+2NH3.H2O=Cu(OH)2↓+(NH4)2SO4、Cu(OH)2+2HCl=CuCl2+H2O.
如图,室温下,挤压胶头滴管.待现象发生时,再打开活塞a,烧瓶中能观察到的现象是先形成蓝色喷泉,然后有蓝色沉淀生成后溶解变为蓝色溶液,有关的化学方程式是NH3+H2O=NH3.H2O、CuSO4+2NH3.H2O=Cu(OH)2↓+(NH4)2SO4、Cu(OH)2+2HCl=CuCl2+H2O.