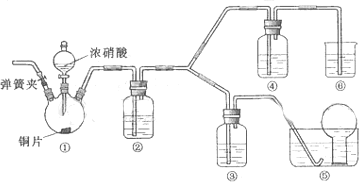
题目内容
20.A、B、C、D为短周期元素,A的M电子层有1个电子,B的最外层电子数为内层电子数的2倍,C的最高化合价为最低化合价绝对值的3倍,C与D同周期,D的原子半径小于C.(1)B位于元素周期表第二周期第IVA族.
(2)C2-离子的结构示意图为
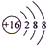 .A+、C2-、D-中离子半径最小的是Na+.(用具体离子符号表示)
.A+、C2-、D-中离子半径最小的是Na+.(用具体离子符号表示)(3)BC2与二氧化碳的结构相似,其结构式为S=C=S.A2C的电子式为
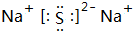 .
.(4)A、D元素最高价氧化物对应水化物相互反应的化学方程式为NaOH+HClO4=NaClO4+H2O.
分析 A、B、C、D为短周期元素,A的M电子层有1个电子,则A为Na;B的最外层电子数为内层电子数的2倍,最外层电子数不超过8,原子只能有2个电子层,最外层电子数为4,故B为碳元素;C的最高化合价为最低化合价绝对值的3倍,处于VIA族,则C为S元素;C与D同周期,D的原子半径小于C,则D为Cl.
解答 解:A、B、C、D为短周期元素,A的M电子层有1个电子,则A为Na;B的最外层电子数为内层电子数的2倍,最外层电子数不超过8,原子只能有2个电子层,最外层电子数为4,故B为碳元素;C的最高化合价为最低化合价绝对值的3倍,处于VIA族,则C为S元素;C与D同周期,D的原子半径小于C,则D为Cl.
(1)B为碳元素,位于元素周期表第二周期第IVA族,故答案为:二;IVA;
(2)S2-离子的结构示意图为 ,离子的电子层结构相同,核电荷数越大离子半径越小,离子的电子层越多离子半径越大,故离子半径:Na<Cl-<S2-,
,离子的电子层结构相同,核电荷数越大离子半径越小,离子的电子层越多离子半径越大,故离子半径:Na<Cl-<S2-,
故答案为: ;Na+;
;Na+;
(3)CS2与二氧化碳的结构相似,其结构式为S=C=S,Na2S的电子式为: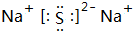 ,
,
故答案为:S=C=S;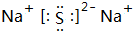 ;
;
(4)A、D元素最高价氧化物对应水化物分别为NaOH、HClO4,相互反应的化学方程式为:NaOH+HClO4=NaClO4+H2O,
故答案为:NaOH+HClO4=NaClO4+H2O.
点评 本题考查结构性质物质关系应用,侧重对化学用语的考查,注意掌握微粒半径比较规律,难度不大.

练习册系列答案
 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案
相关题目
10.化学与社会、生产、生活密切相关.下列说法正确的是( )
| A. | 为了增加食物的营养成分,可以大量使用食品添加剂 | |
| B. | 加碘盐是食盐中加入碘单质 | |
| C. | 石英可用于生产光导纤维 | |
| D. | 从海水中提取物质都必须通过化学反应才能实现 |
11.一定量的铁粉和过量的3mol•L-1硫酸反应,当向其中加入少量的下物质:①铁片 ②铜粉 ③浓硫酸 ④石墨 ⑤二氧化锰 ⑥饱和食盐水 ⑦CuSO4 ⑧NaNO3晶体时,能够加快反应速率,又不影响产生H2总量的是( )
| A. | ①③⑧ | B. | ②③④ | C. | ①④⑥ | D. | ④⑤⑦ |
8.化学对环境保护有积极的意义,下列说法错误的是( )
| A. | 提高燃料的燃烧效率的意义在于节约能源、节省资源、减少污染 | |
| B. | CO、NO、NO2、SO2都是大气污染气体,在空气中都能稳定存在 | |
| C. | 按照绿色化学的原则,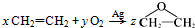 (式中的系数x,y,z均为整数),则(x+y+z)的最小数值为5 (式中的系数x,y,z均为整数),则(x+y+z)的最小数值为5 | |
| D. | 使用“无磷洗涤剂”,防止水体富营养化 |
15.根据原子结构及元素周期律的知识,下列推断正确的是( )
| A. | 碱金属单质都能在氧气中燃烧生成过氧化物 | |
| B. | N、O、F氢化物的稳定性依次减弱 | |
| C. | P、S、Cl最高正价依次升高 | |
| D. | 同主族元素含氧酸的酸性随核电荷数的增加而减弱 |
5.下列离子方程式与所述事实不相符的是( )
| A. | 用铁作电极电解饱和食盐水:Fe+2H2O$\frac{\underline{\;电解\;}}{\;}$Fe(OH)2+H2↑ | |
| B. | 偏铝酸钠溶液能使酚酞试液变红:AlO2-+2H2O?Al(OH)3+OH- | |
| C. | 苯酚钠溶液中通入 | |
| D. | AgOH沉淀溶于氨水:AgOH+2NH3•H2O═[Ag(NH3)2]++OH-+2H2O |

 .
. .
.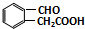 或
或 (任写一种).
(任写一种).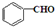 与CH3CHO两者之间能发生类似①、②的两步反应,则生成有机物的结构简式为
与CH3CHO两者之间能发生类似①、②的两步反应,则生成有机物的结构简式为 .
.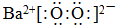 .
.